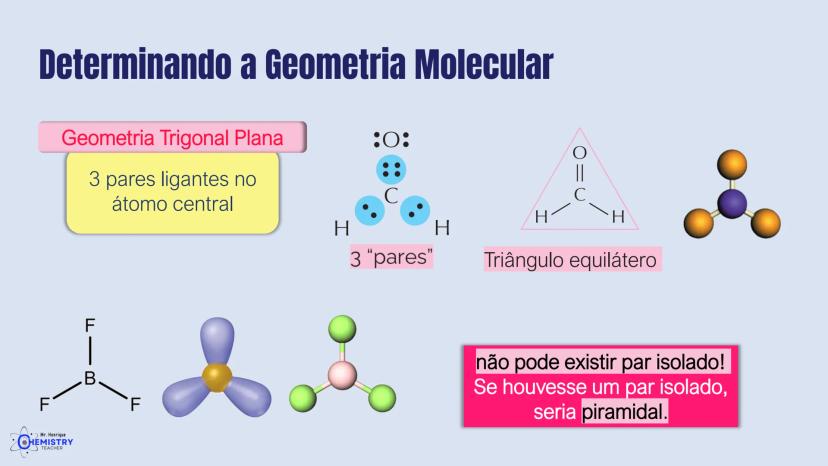
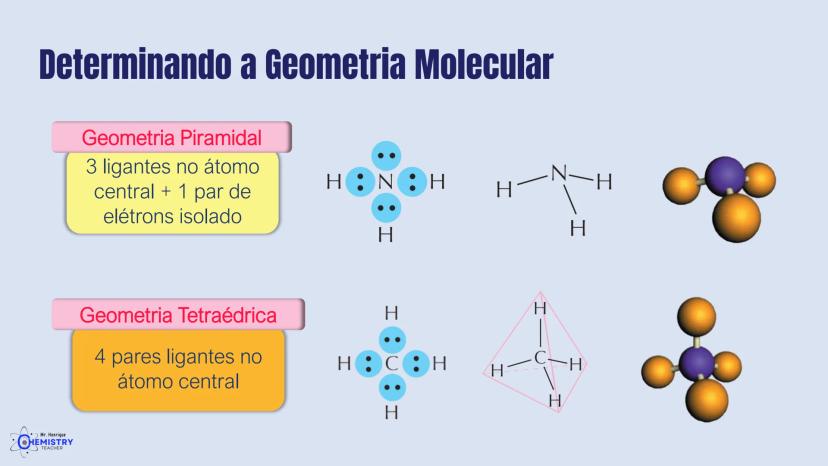
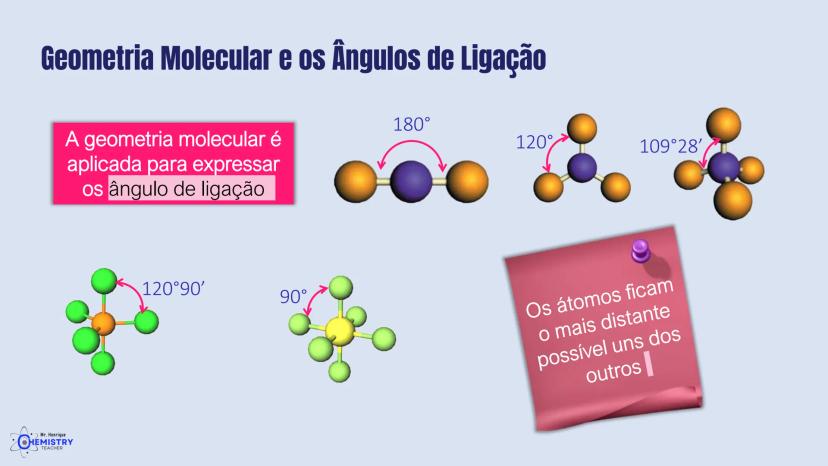
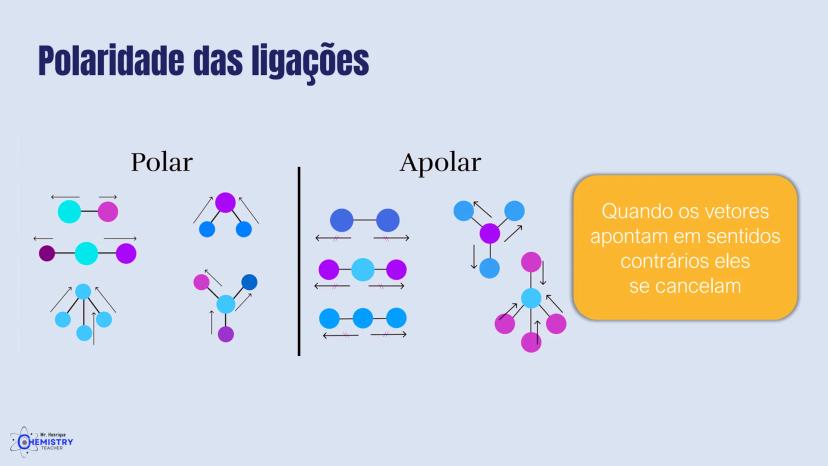
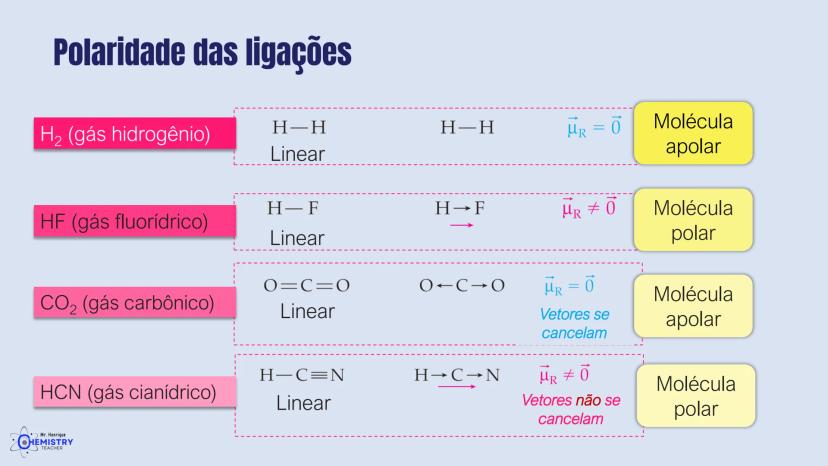
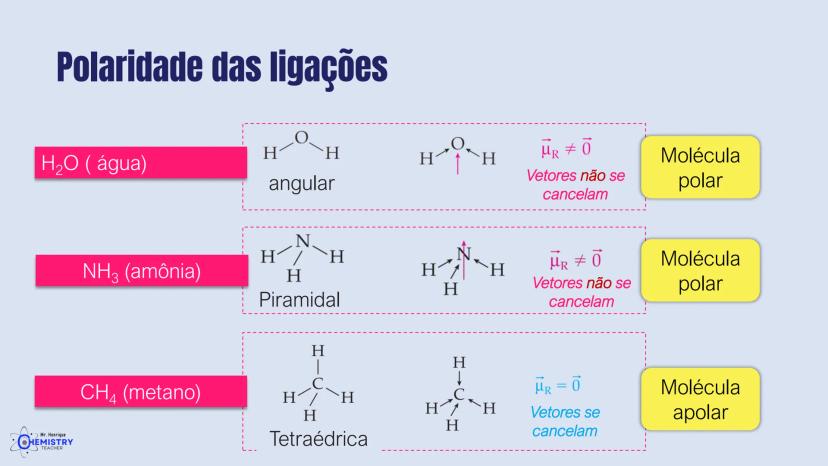
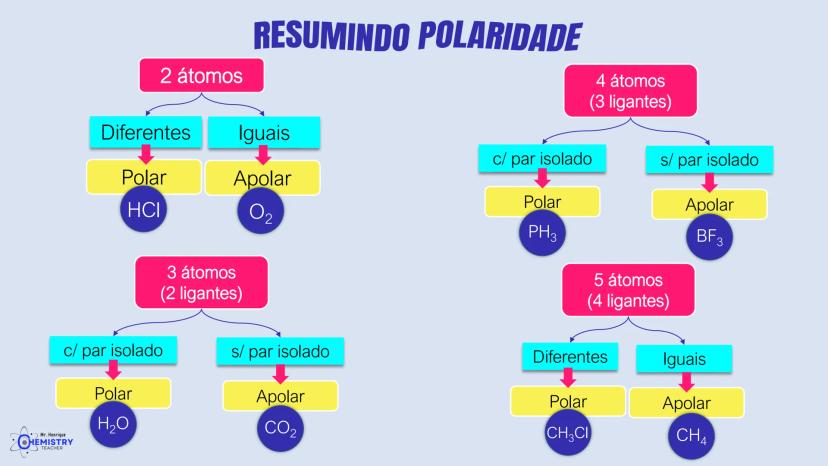
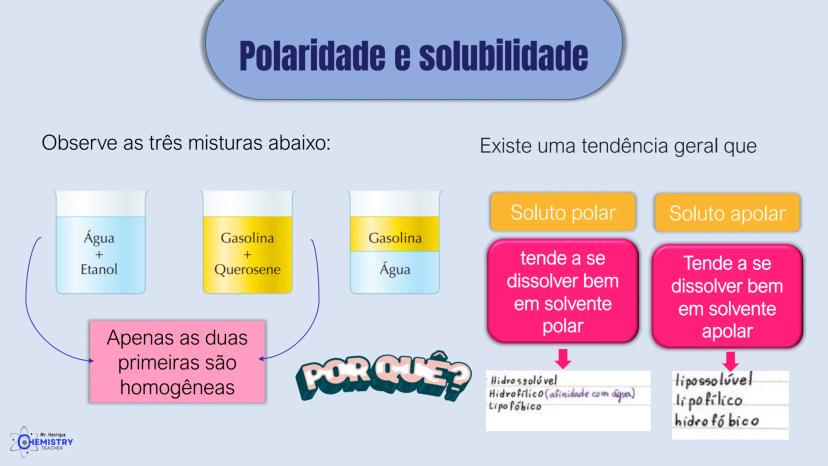
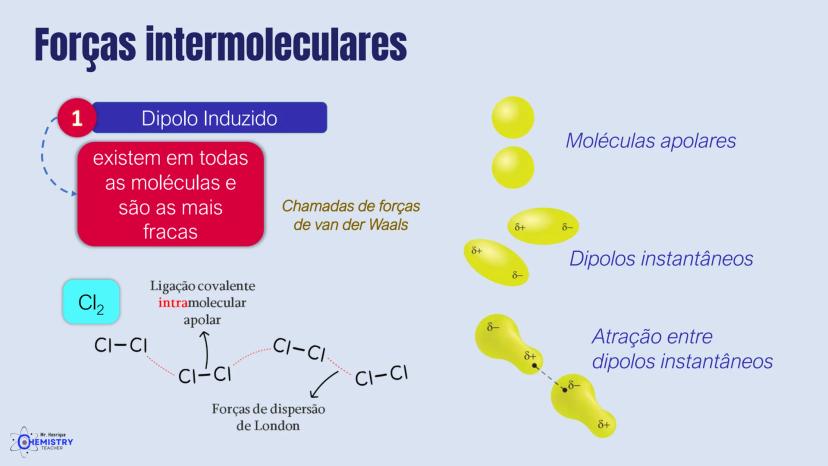
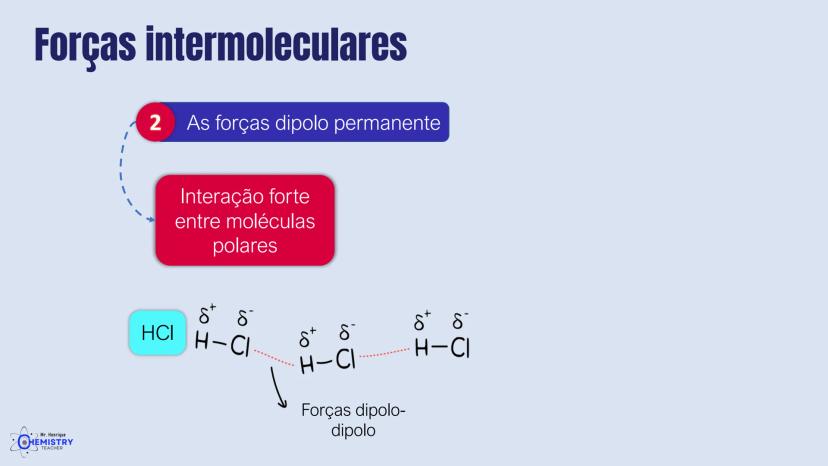
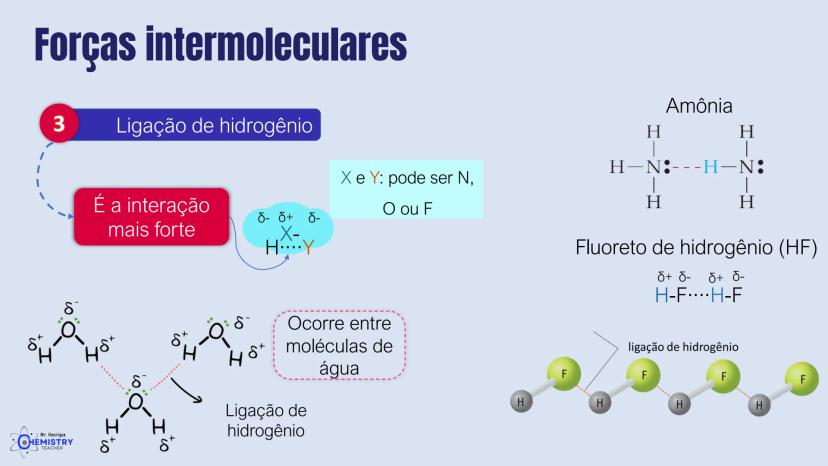
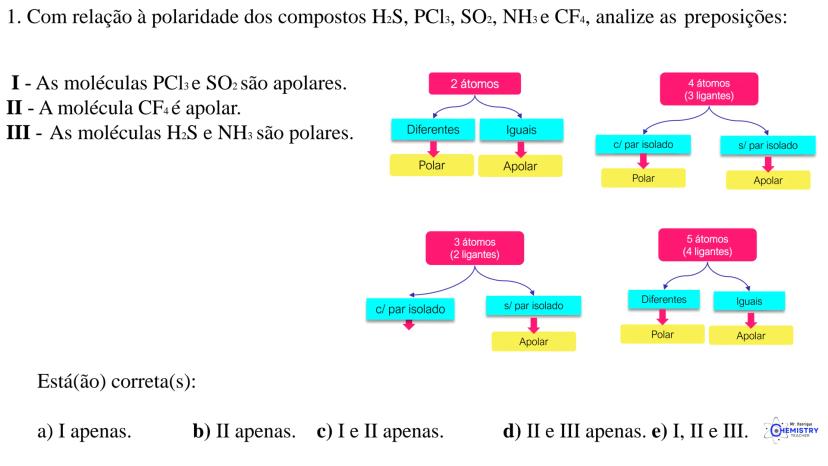
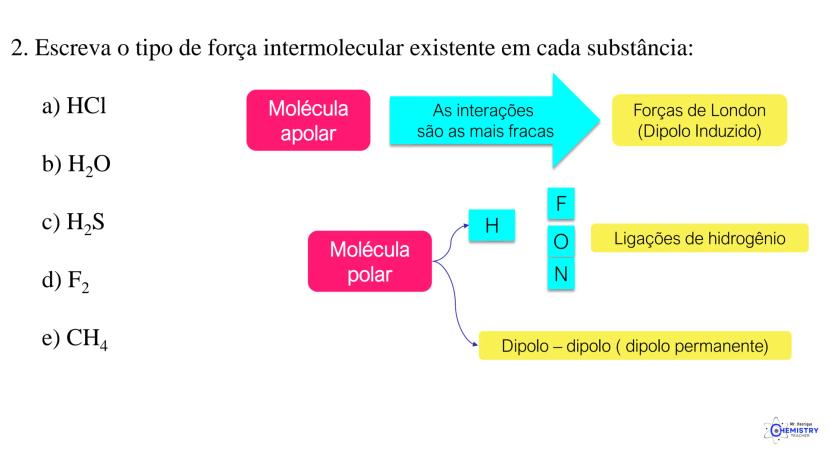
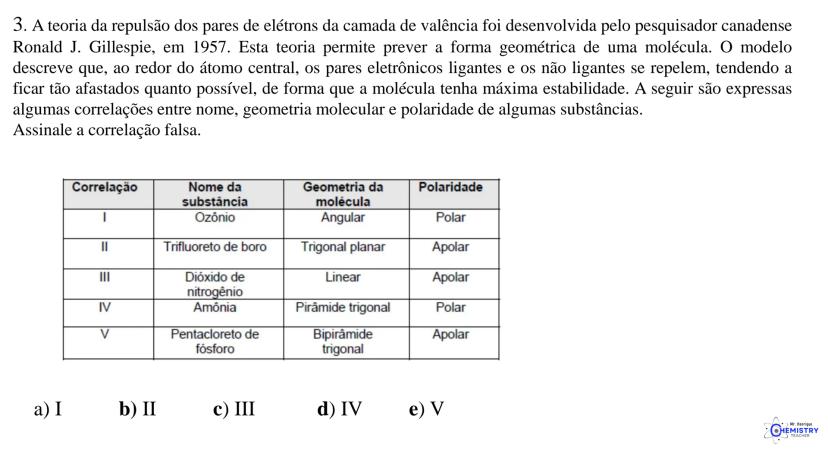
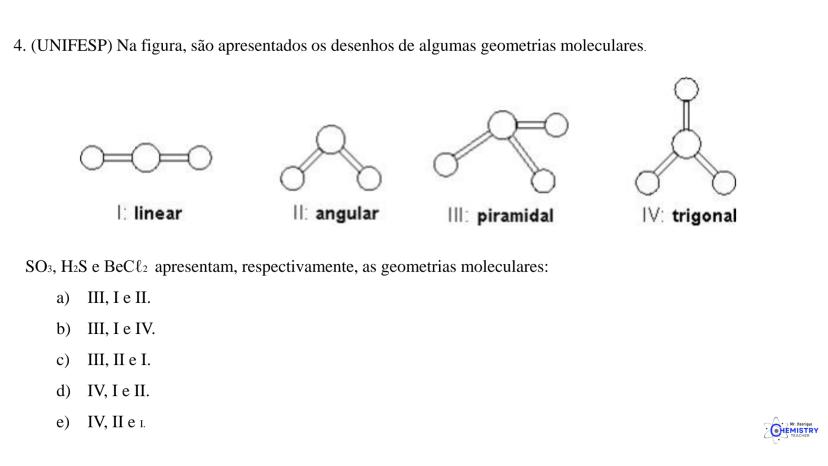
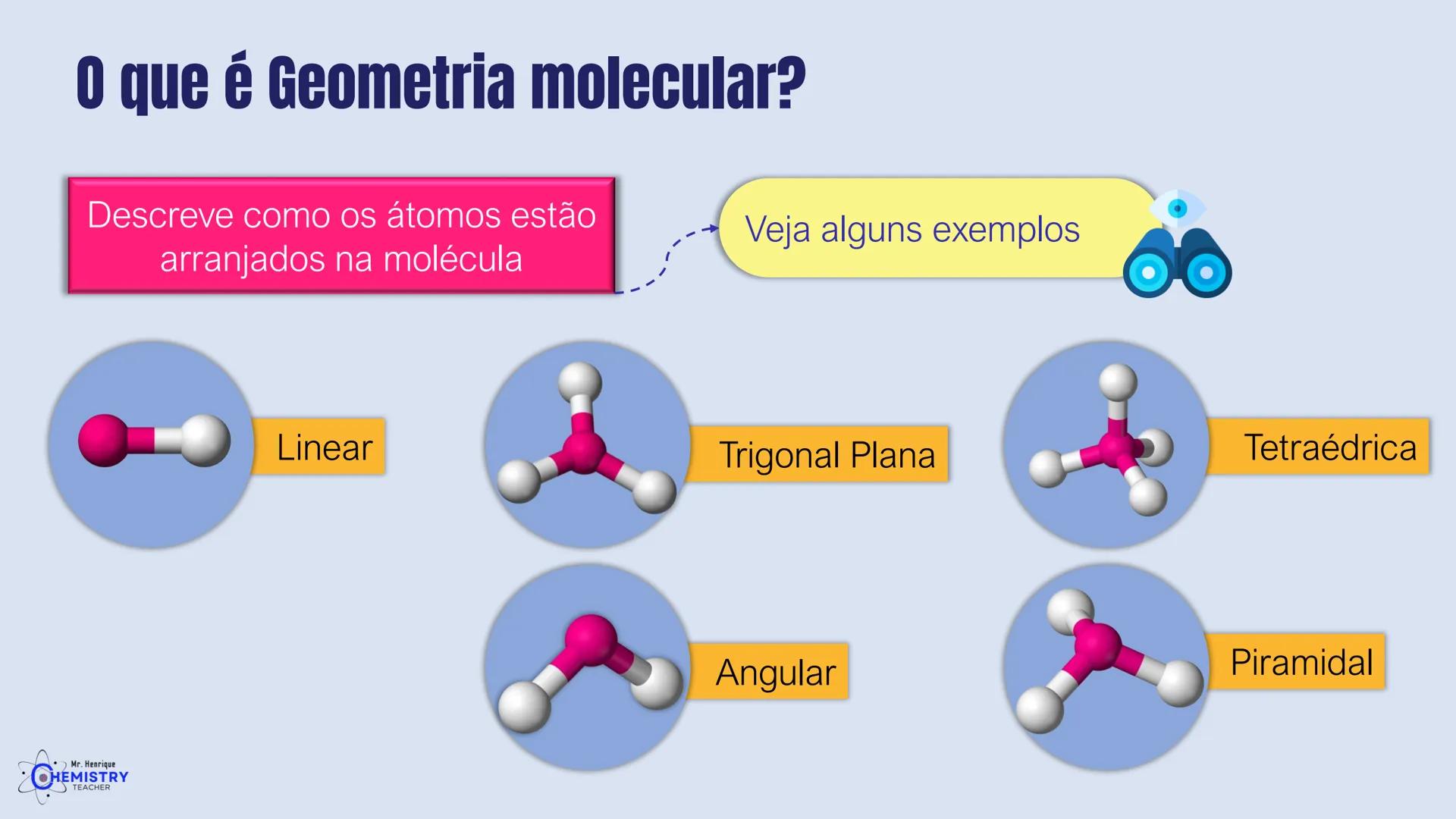
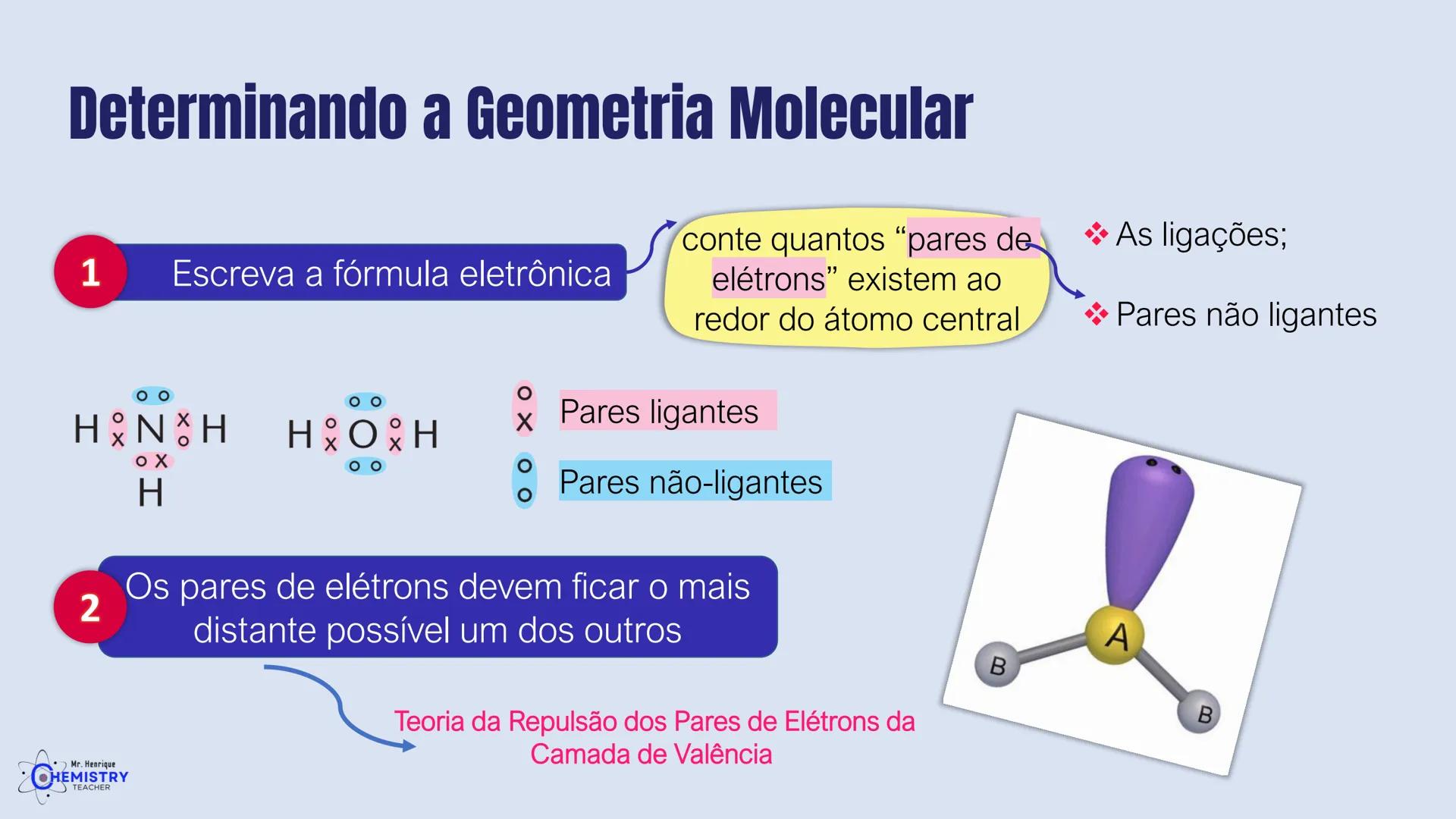
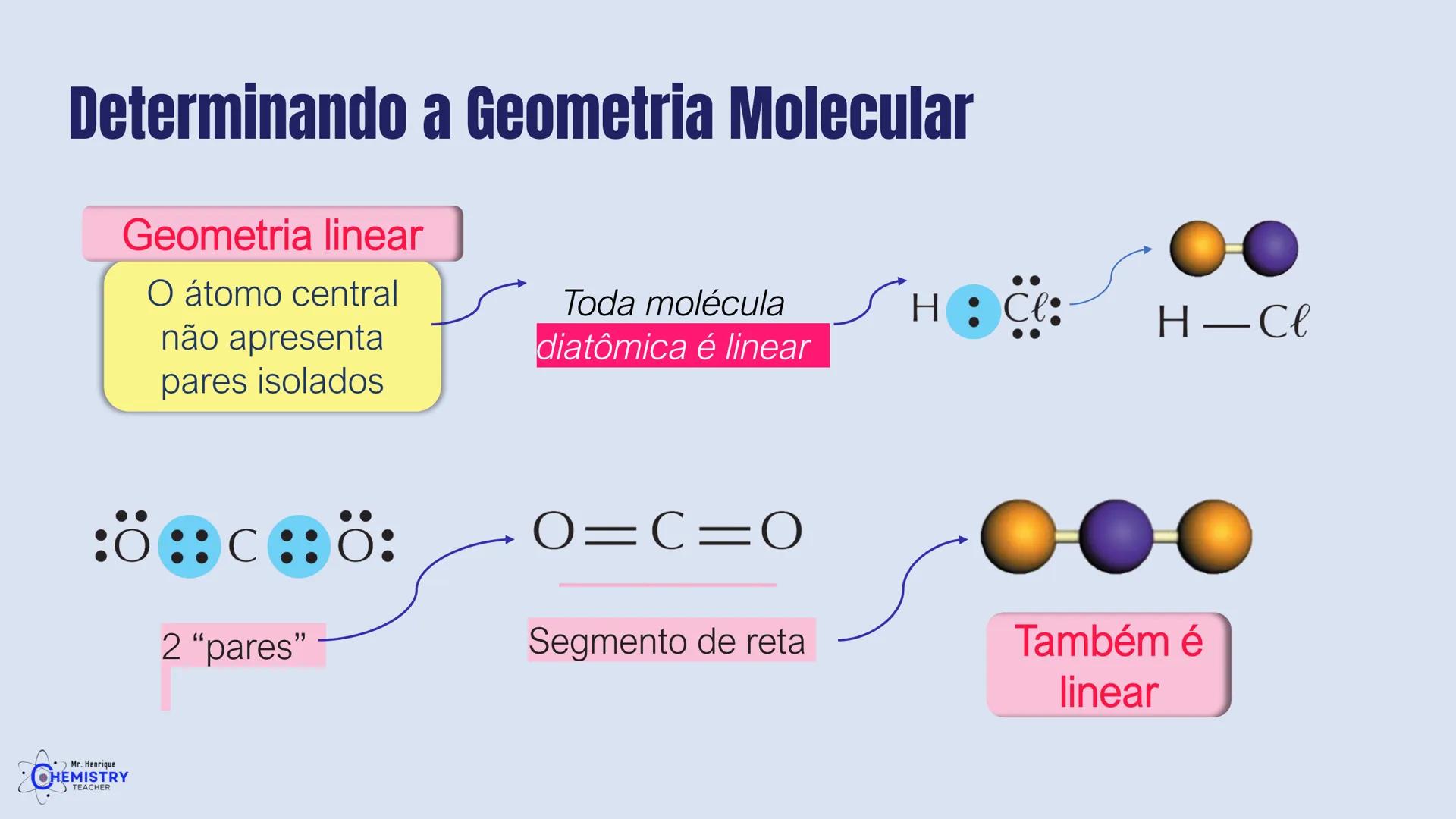
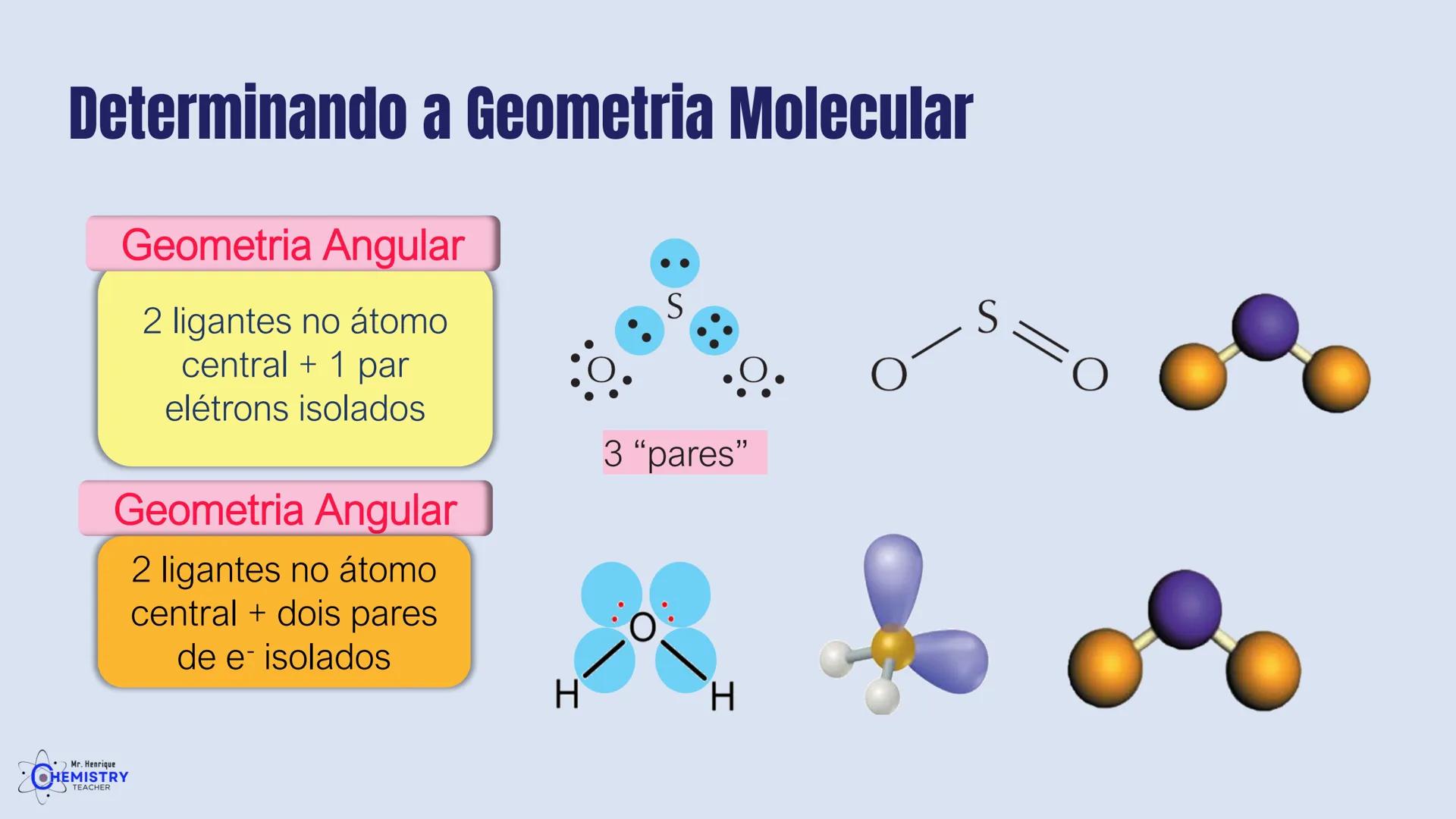
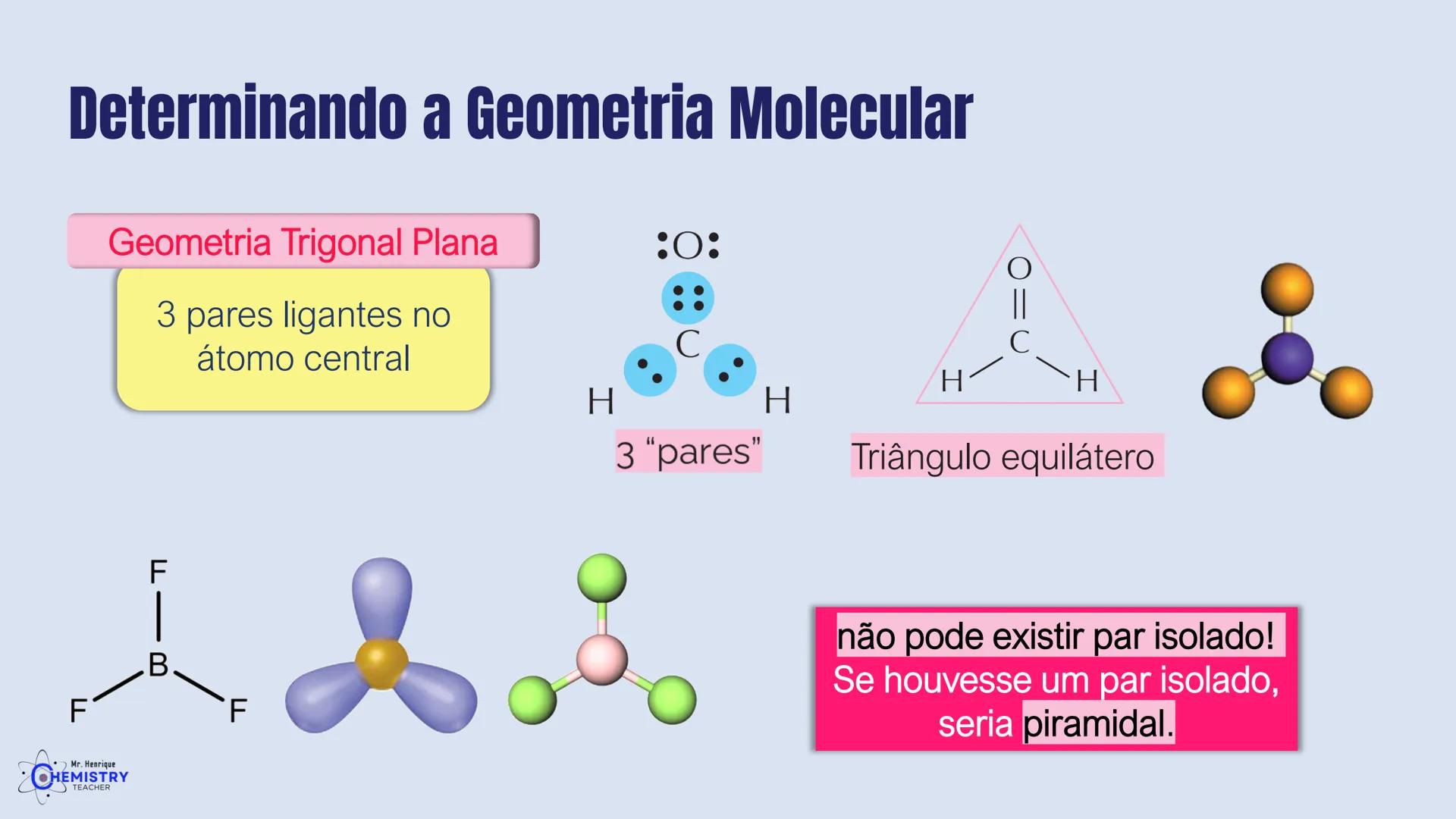
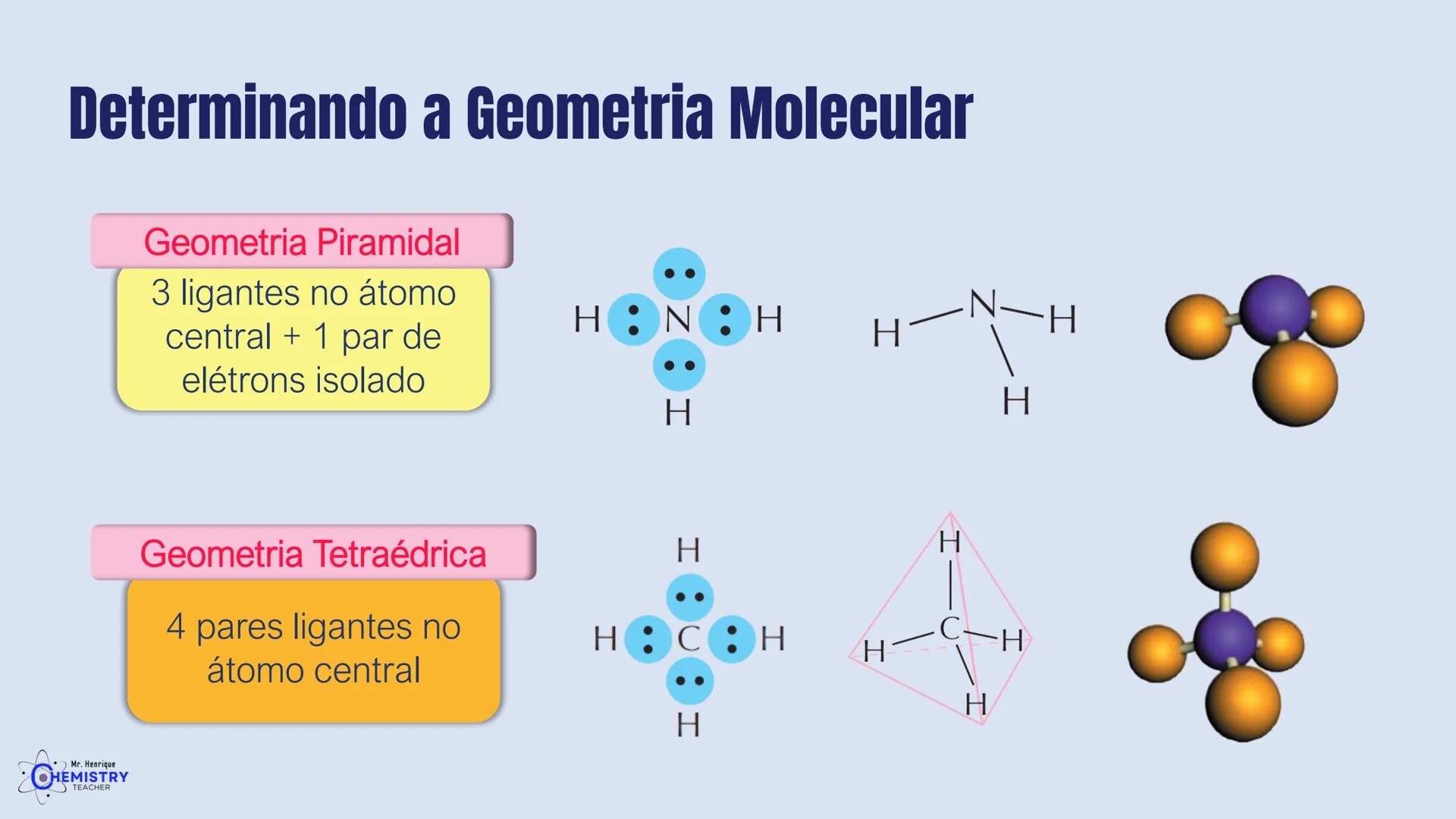
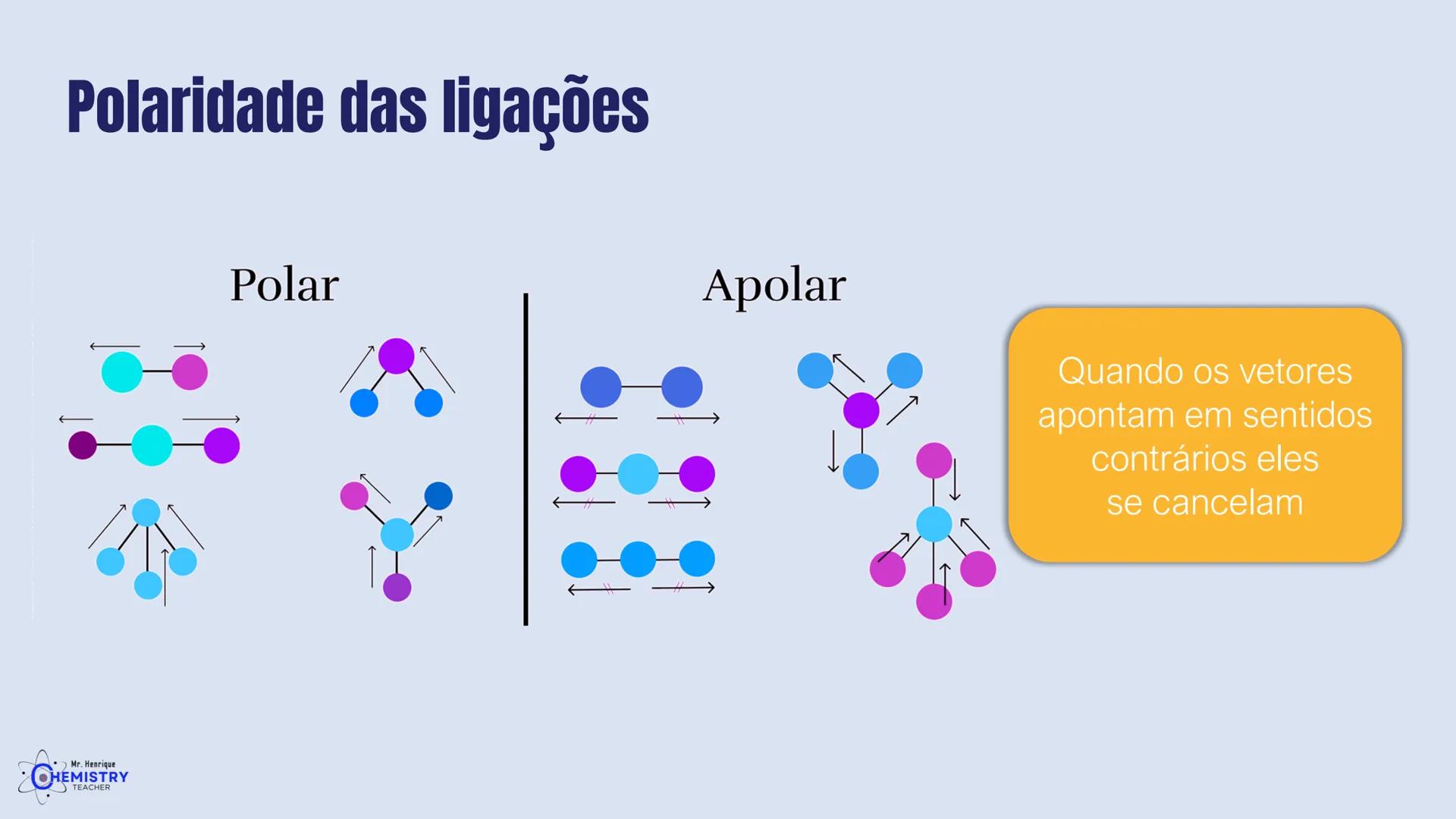
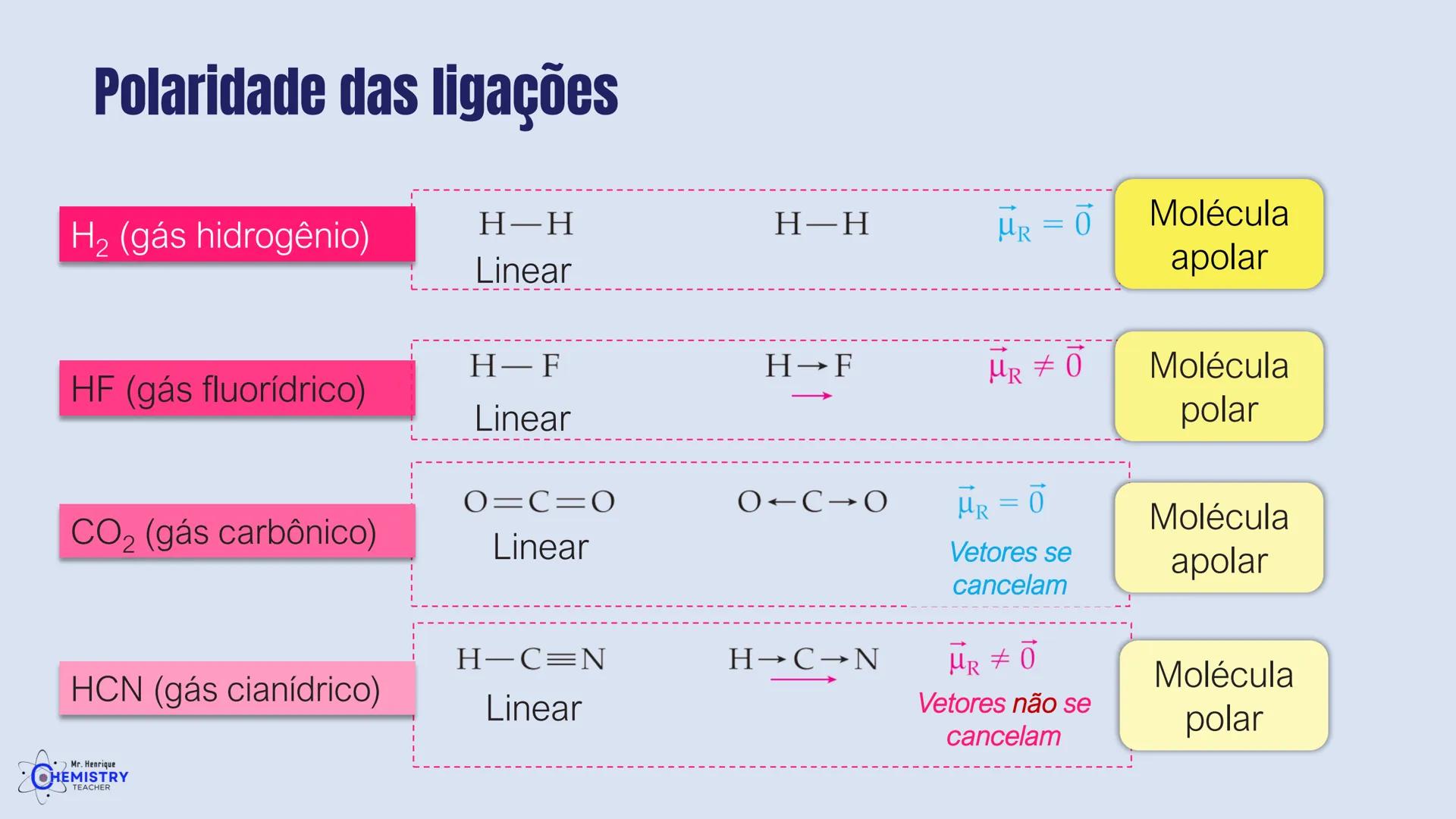
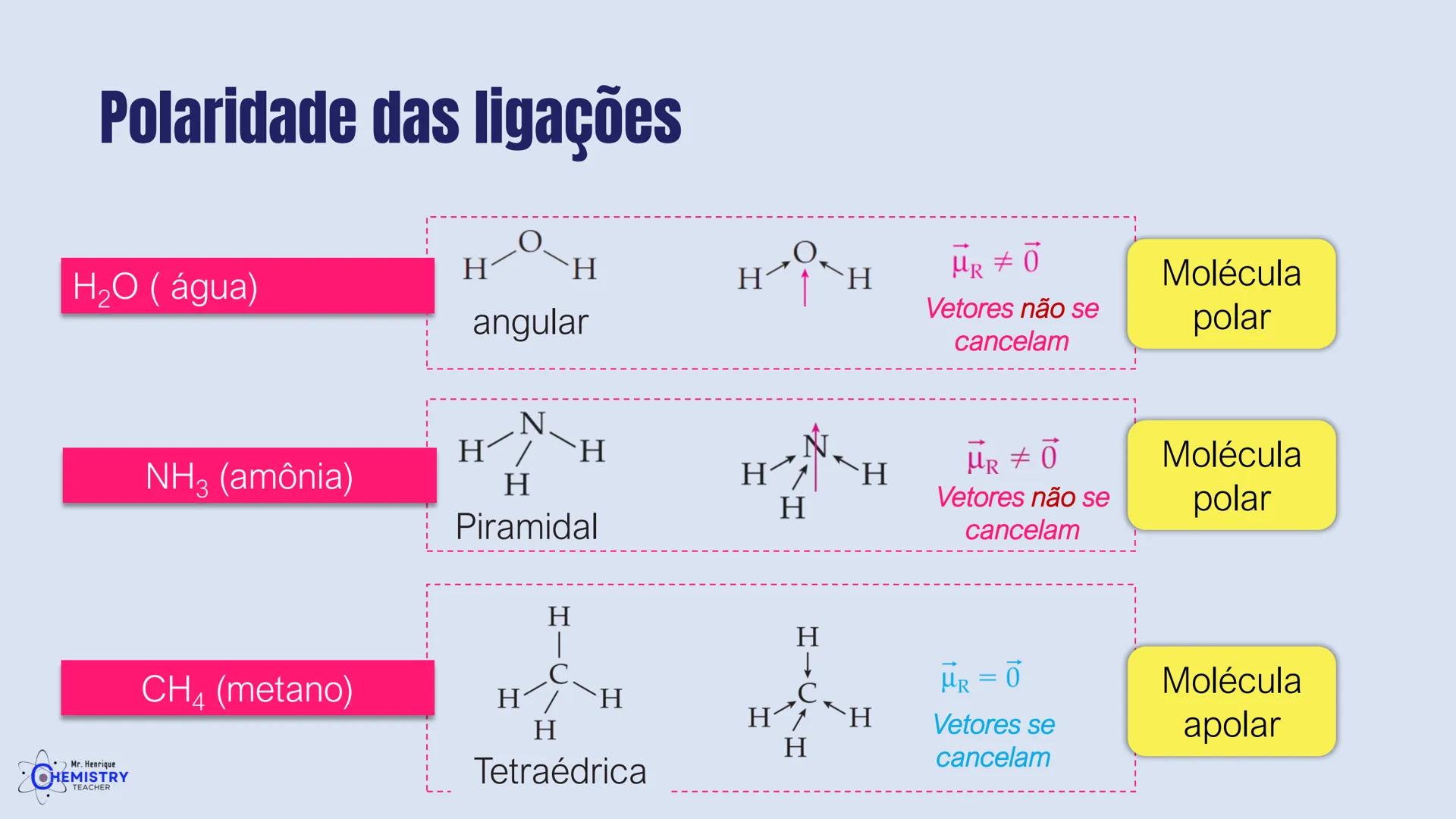
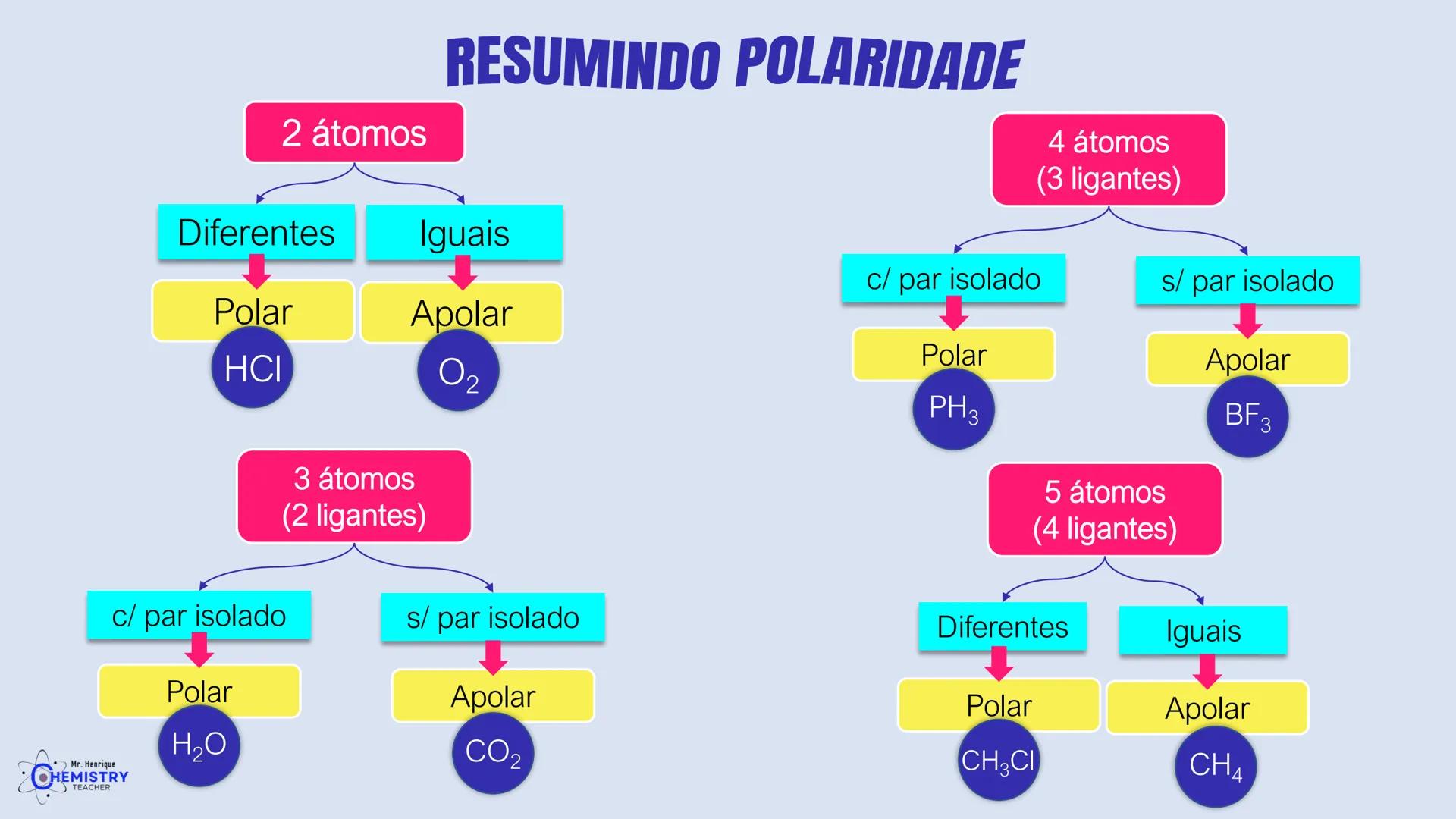
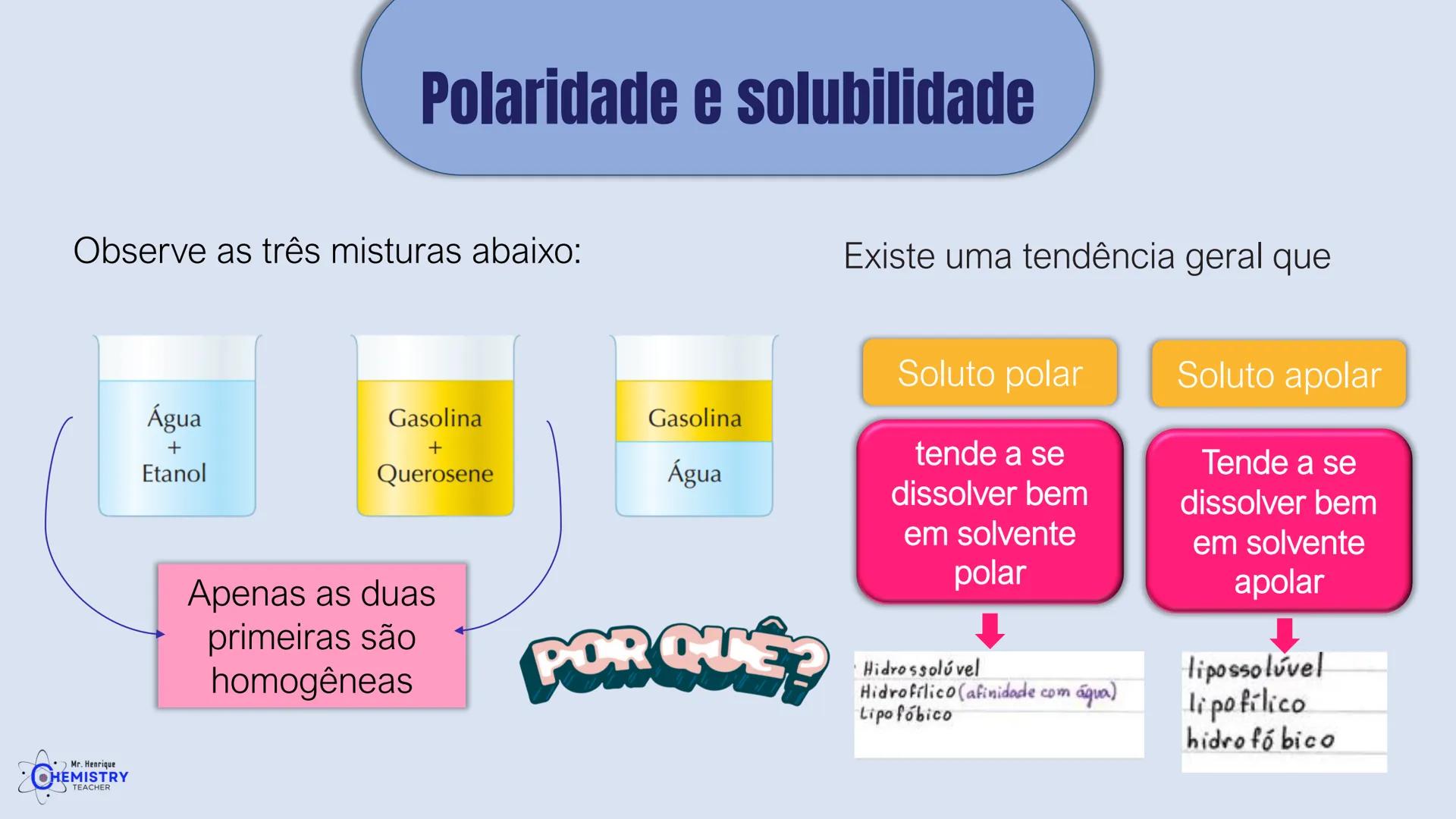
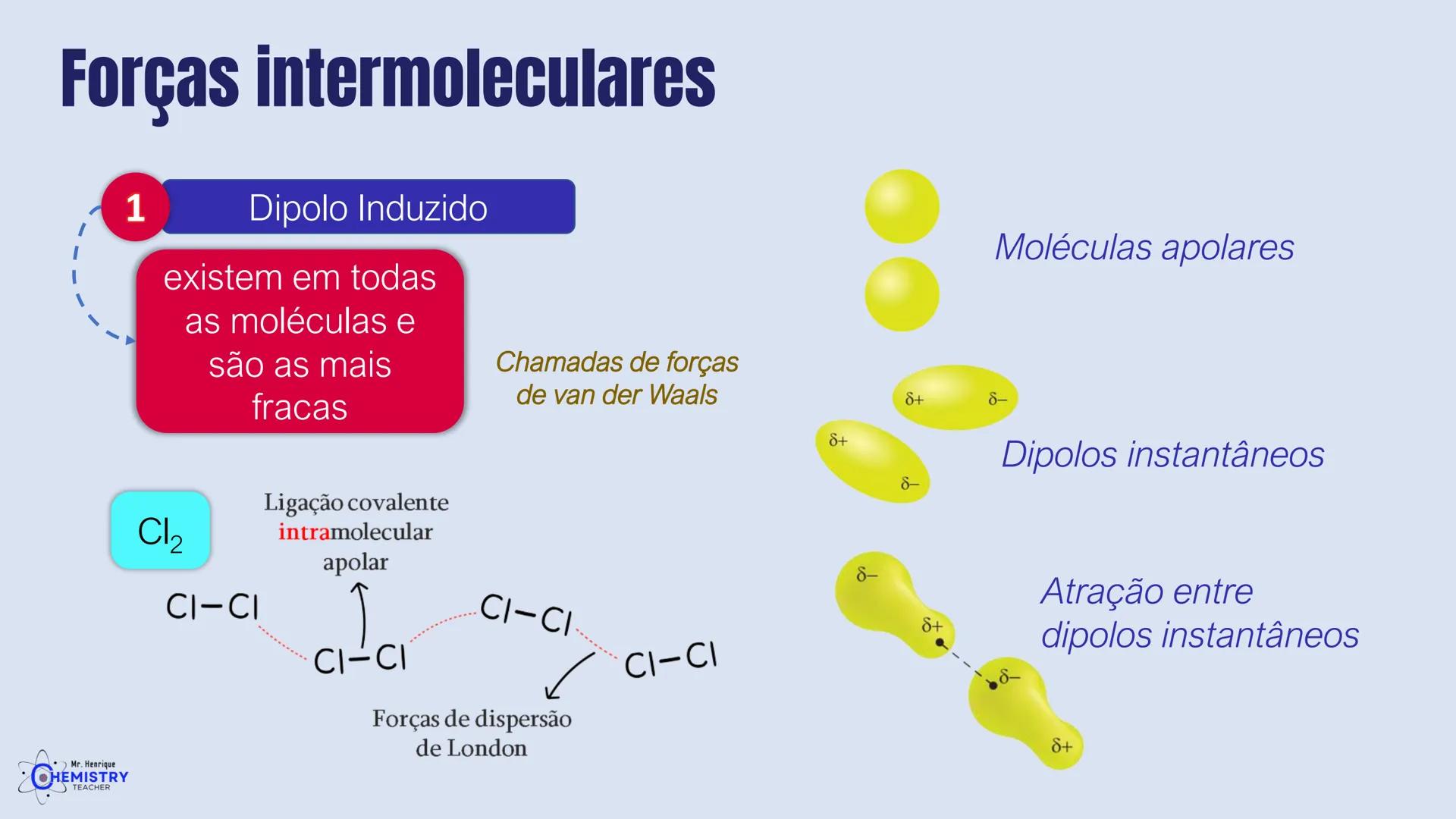
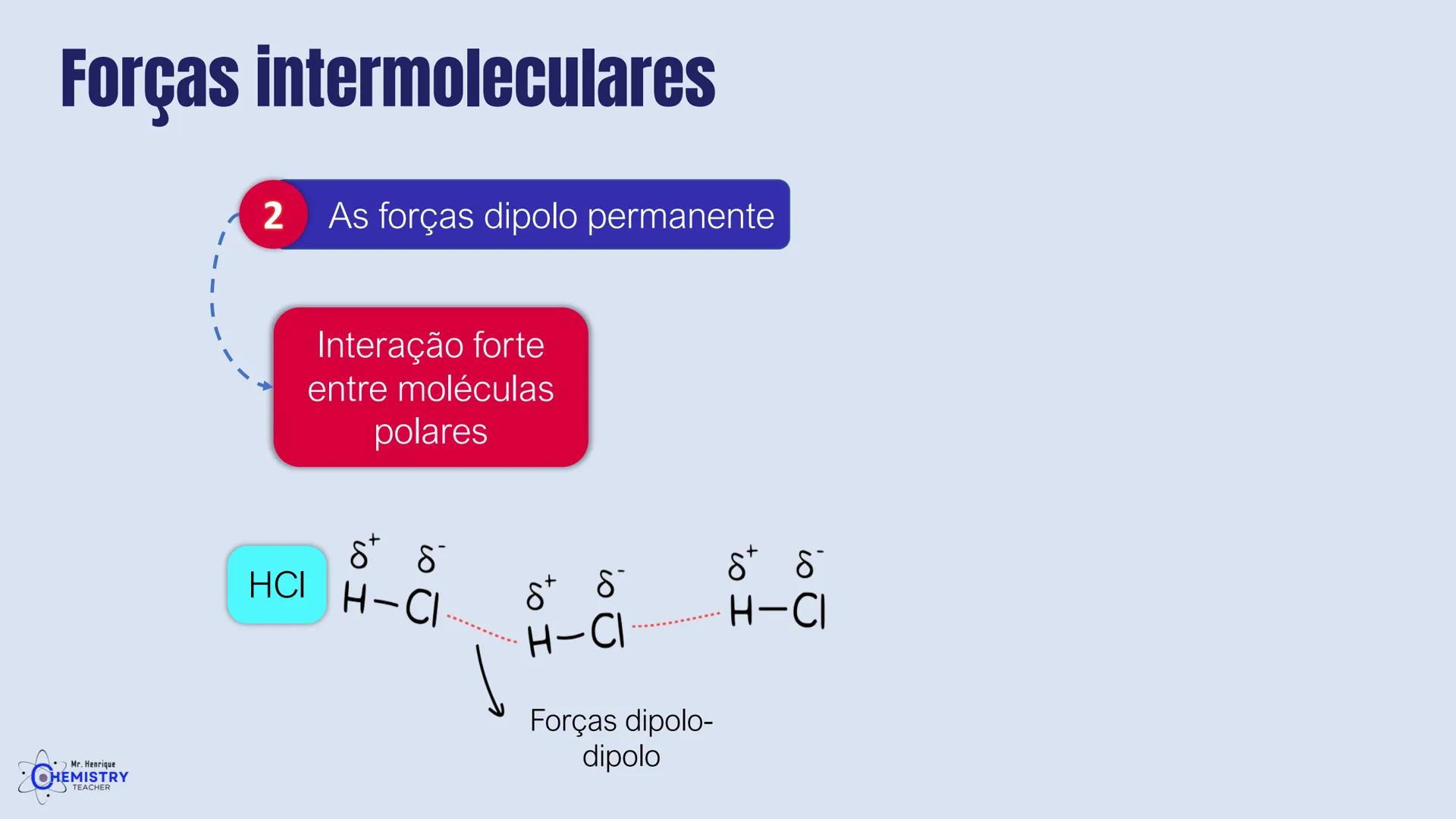
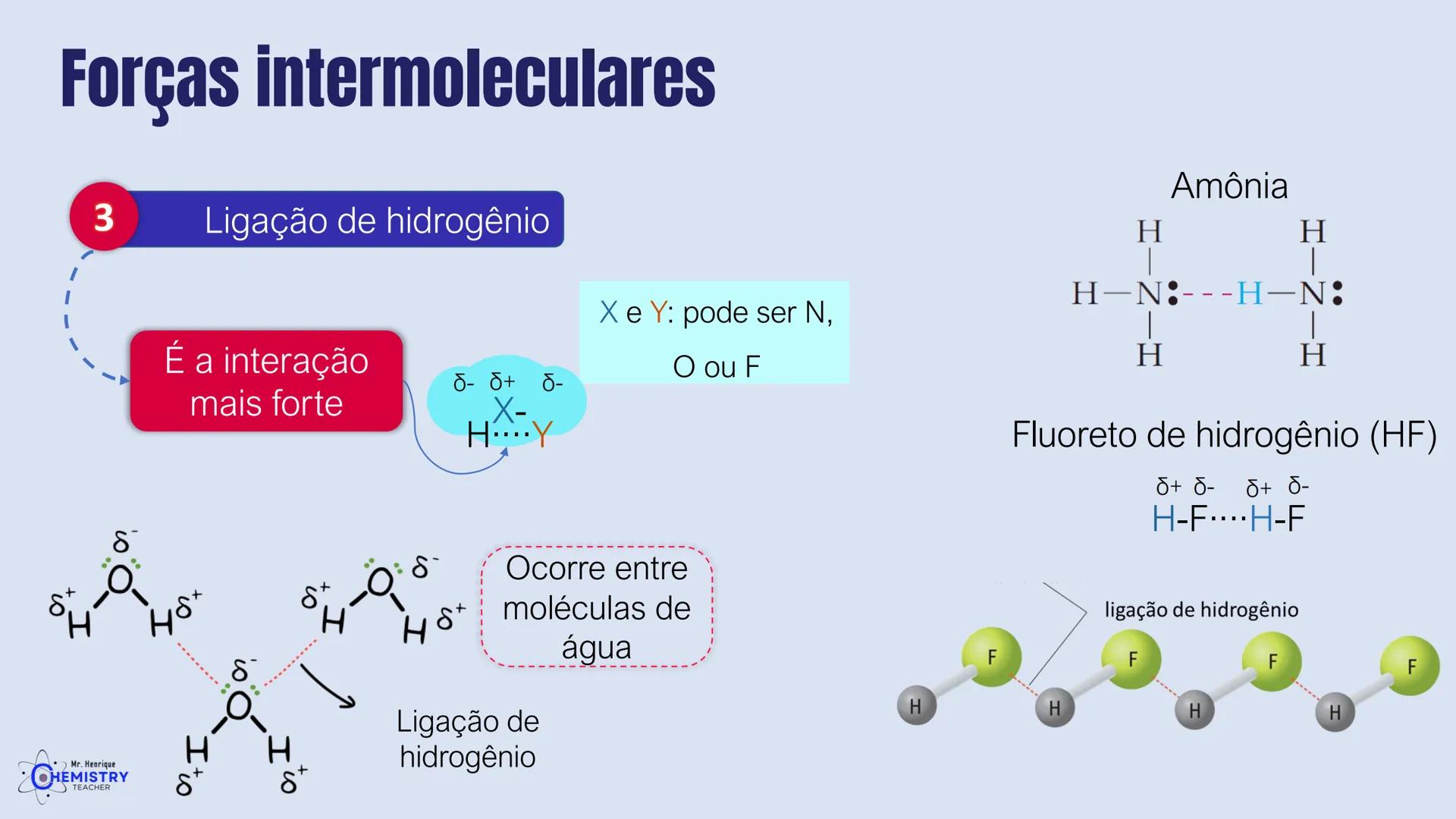
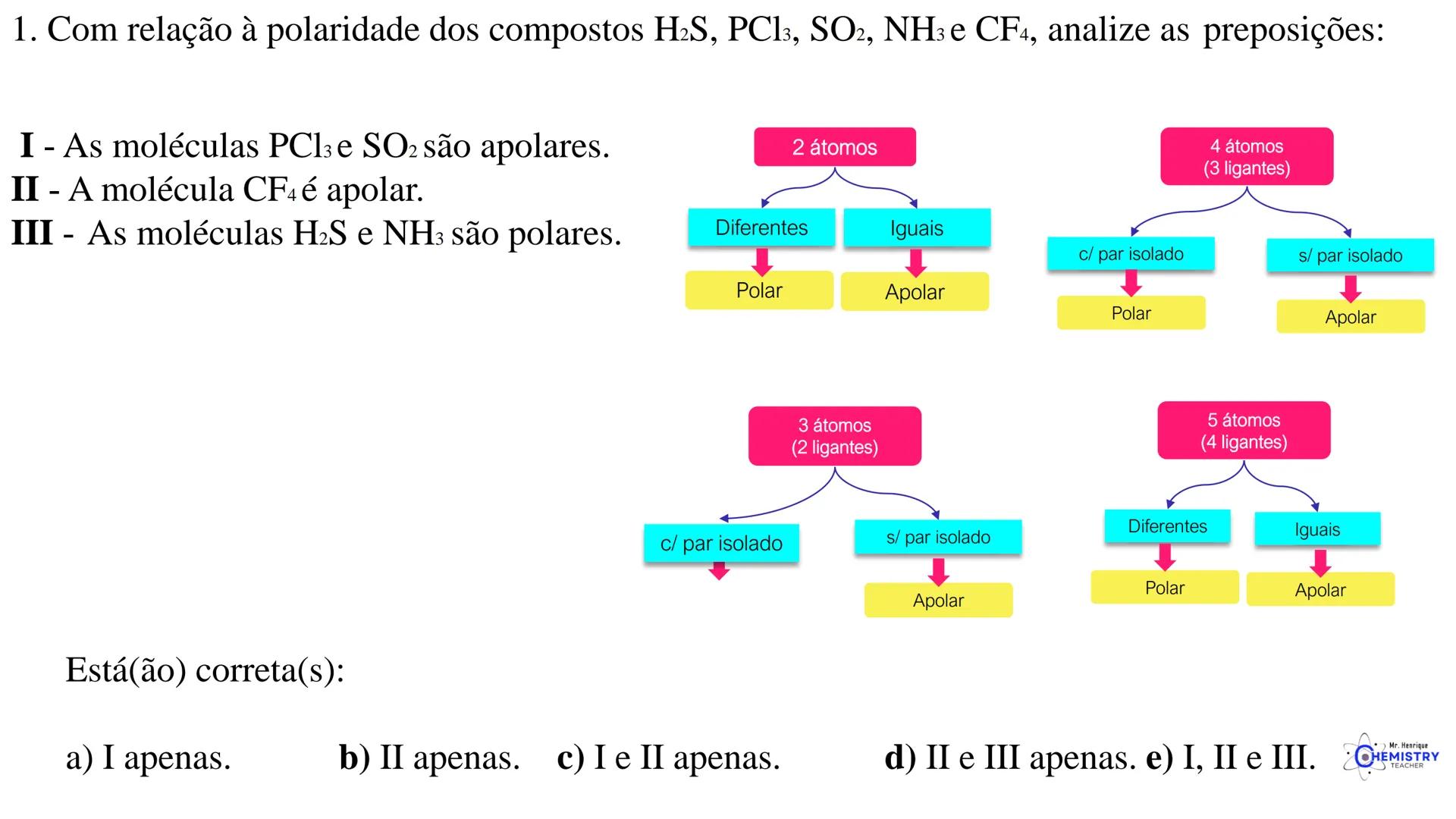
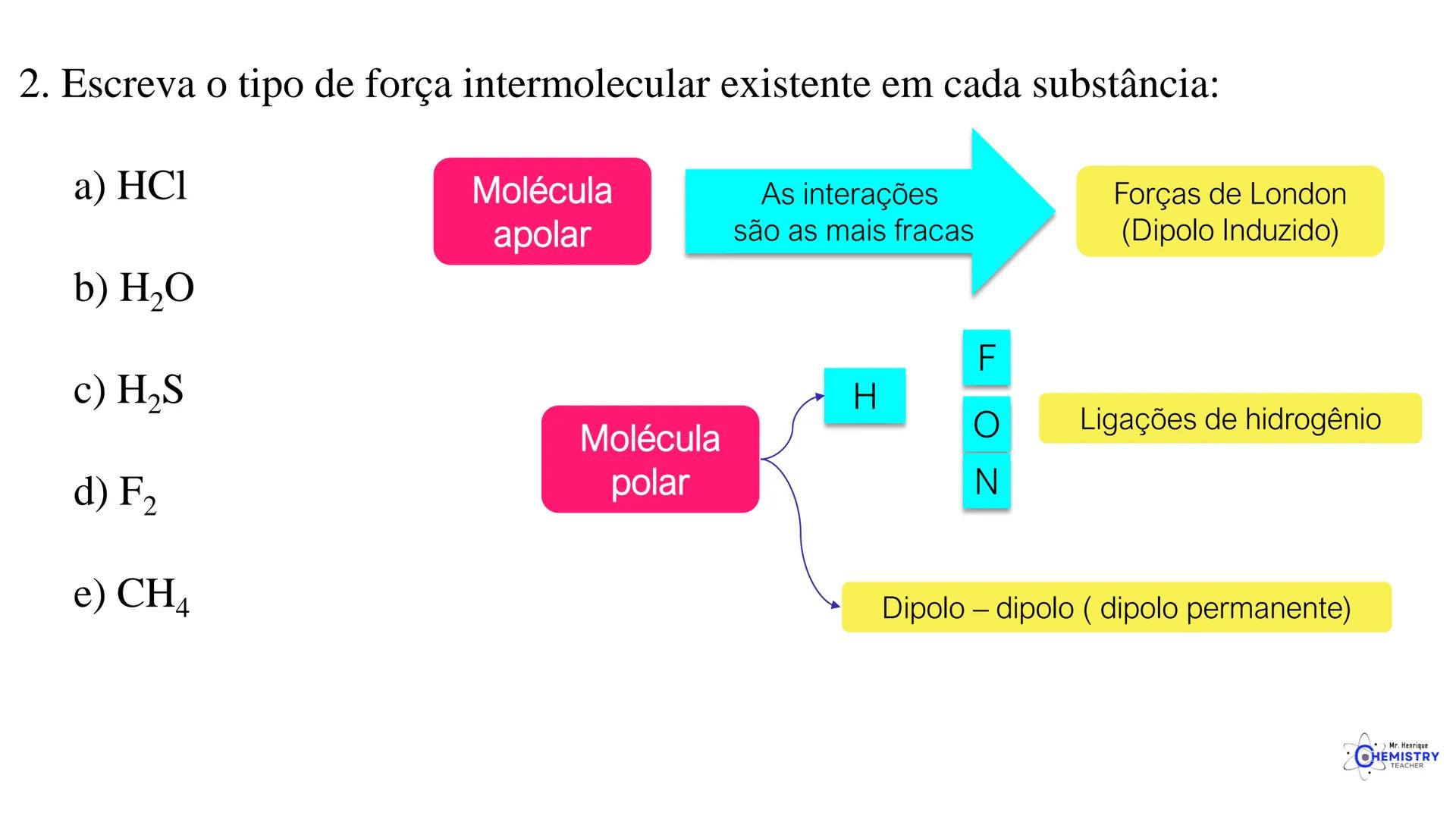
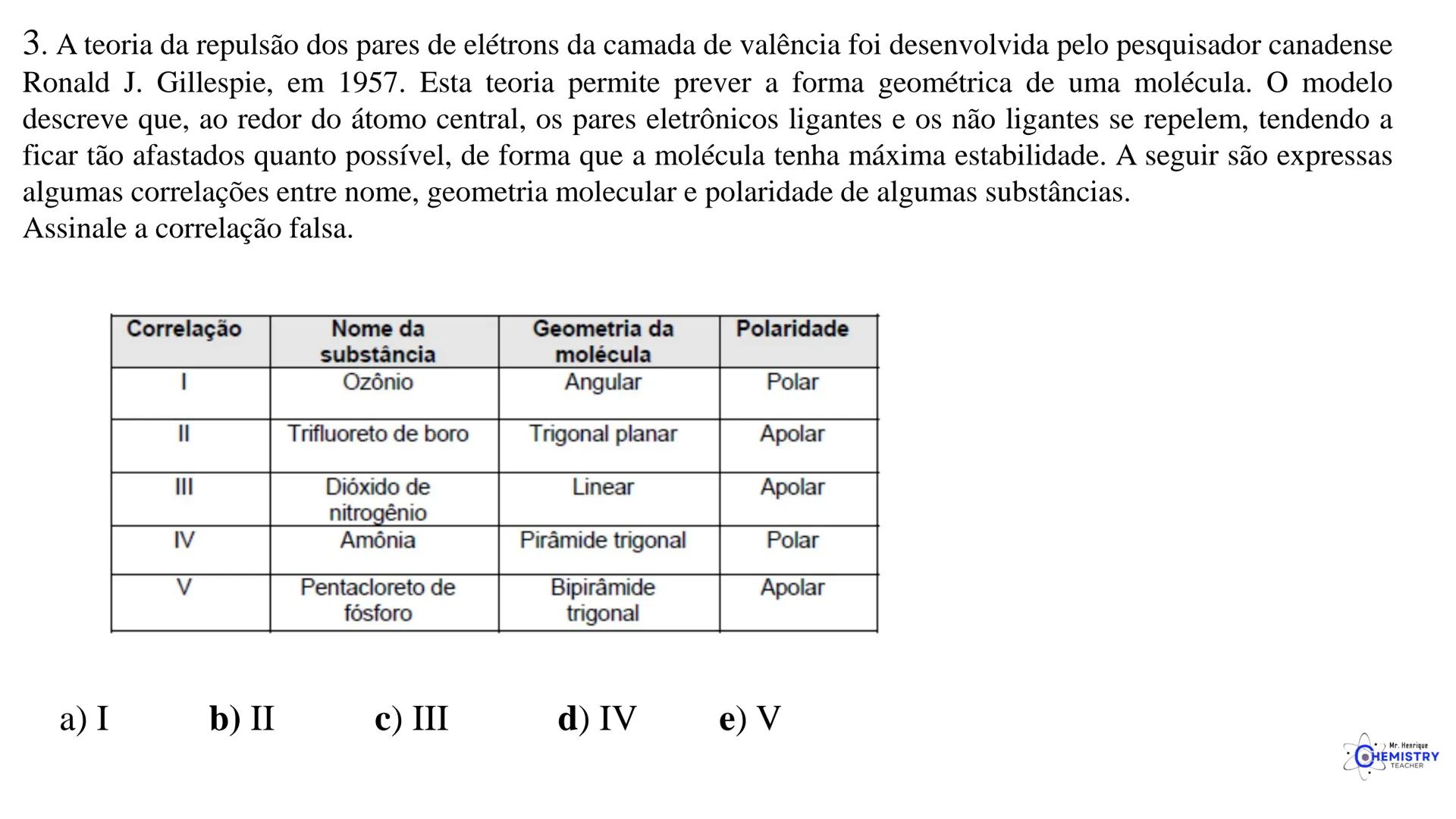
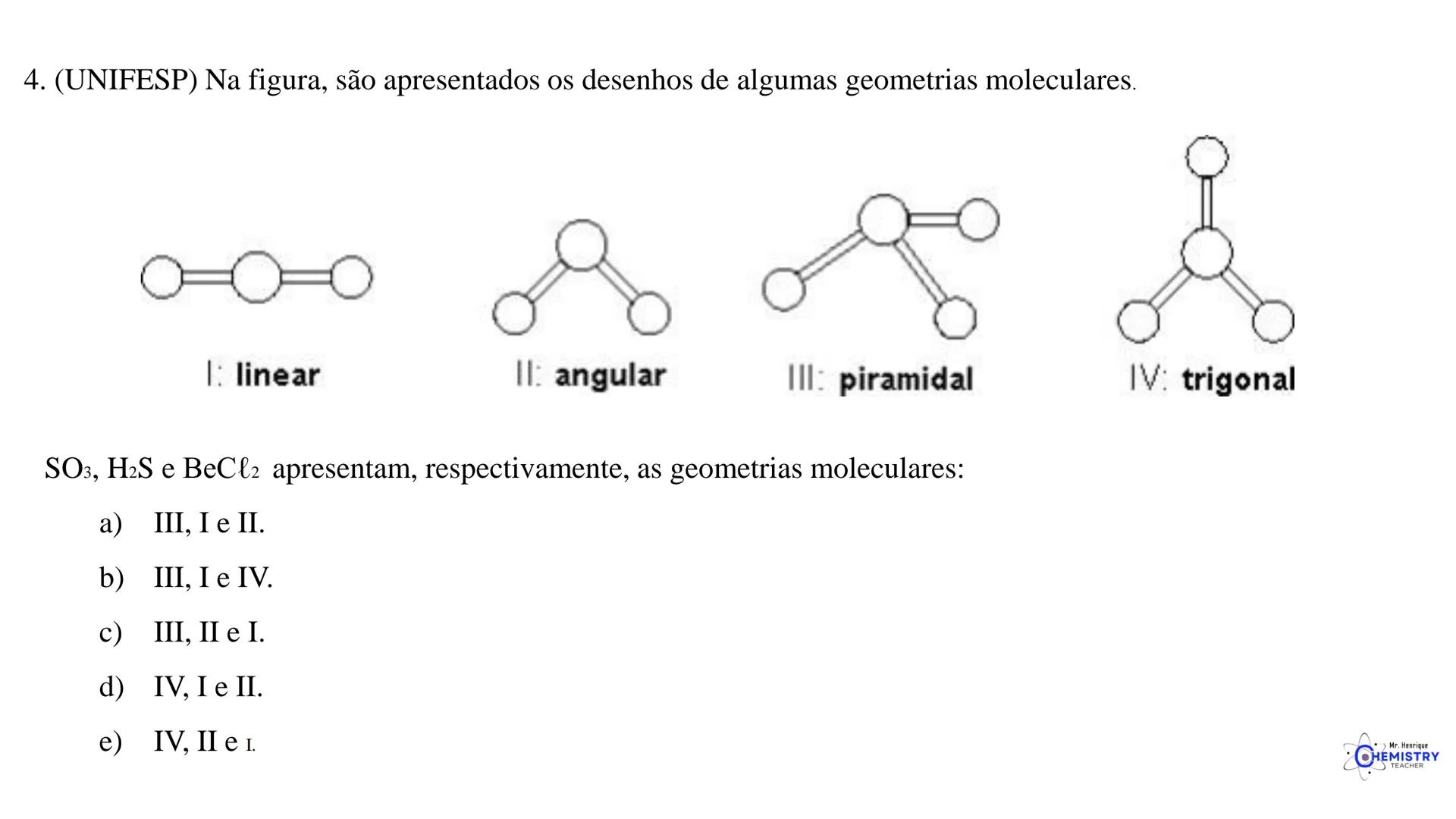
Determinando a Geometria Molecular: Bipirâmide Trigonal e Octaédrica
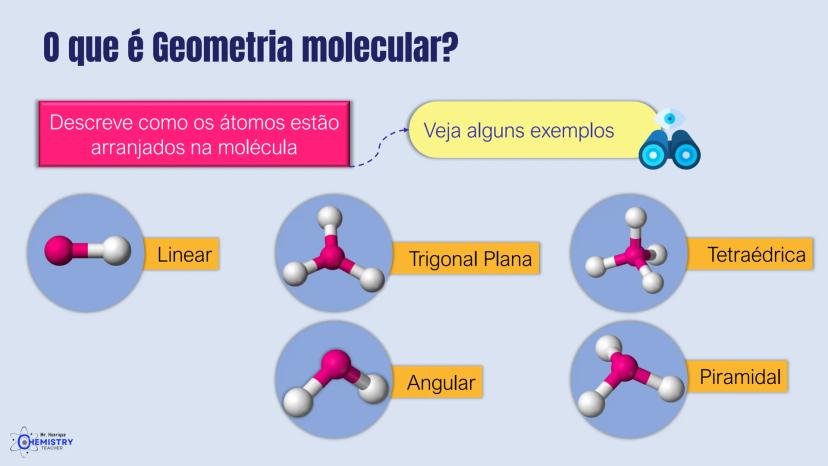
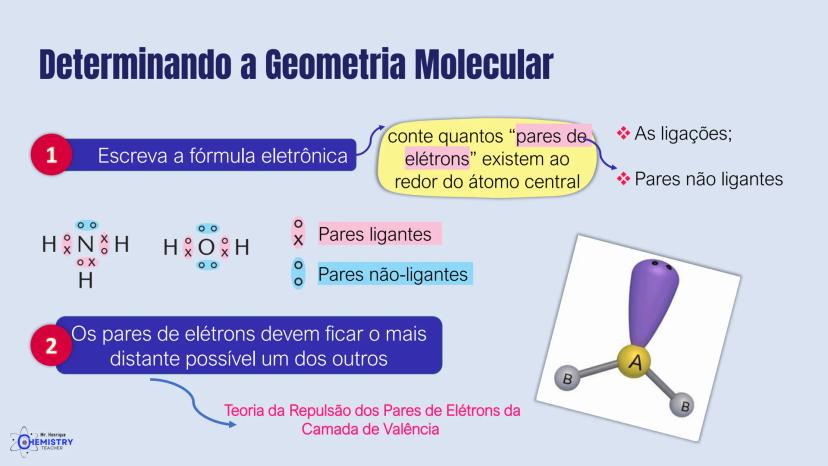
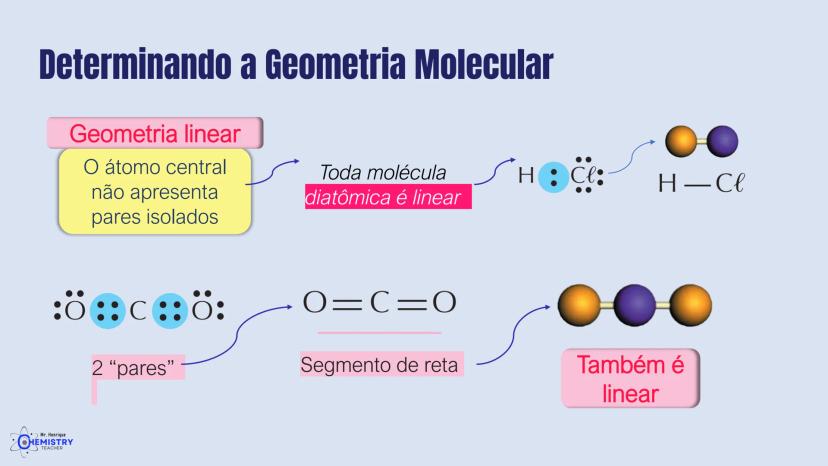
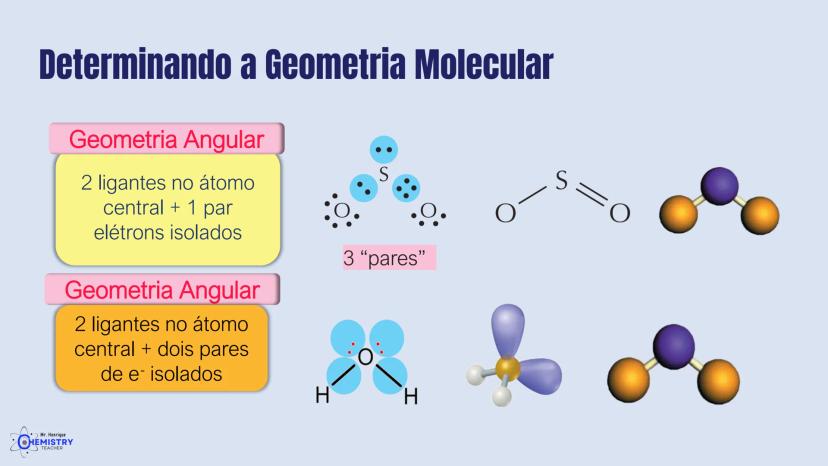
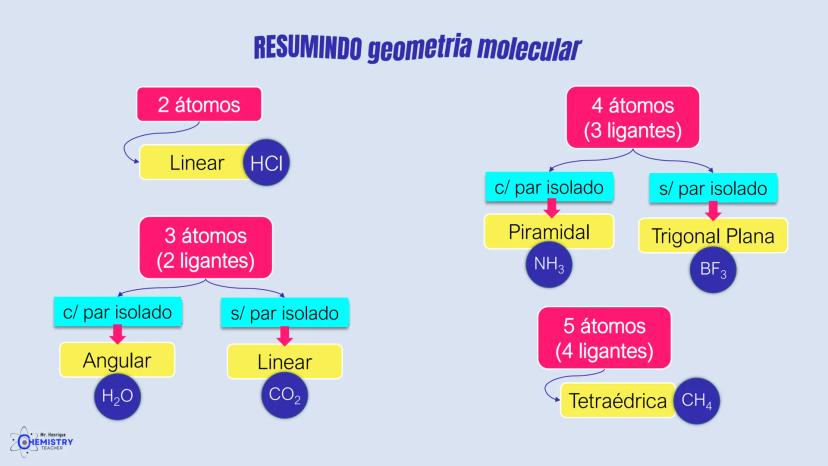
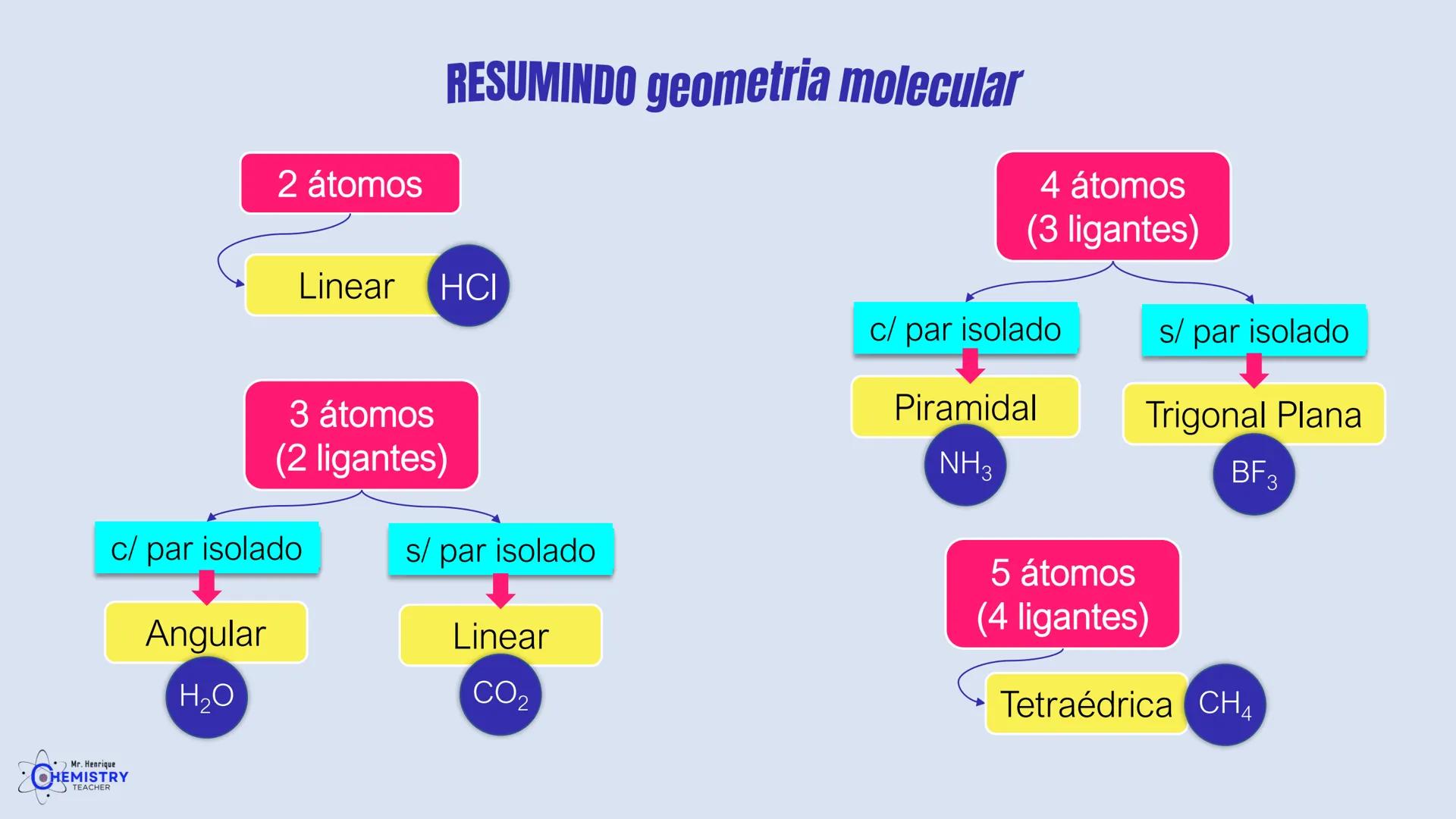
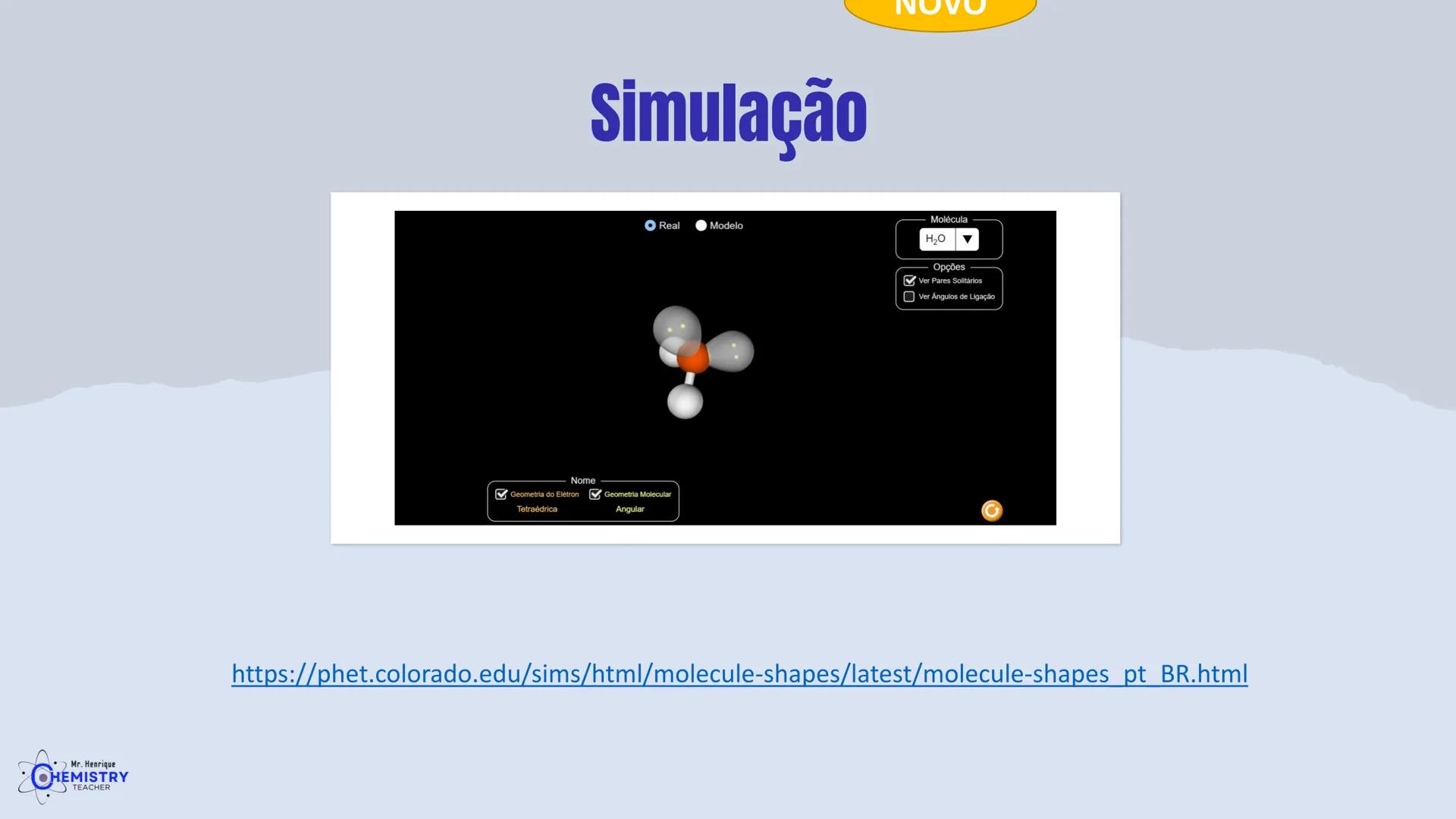
Para moléculas mais complexas, temos geometrias que acomodam mais ligantes ao redor do átomo central.
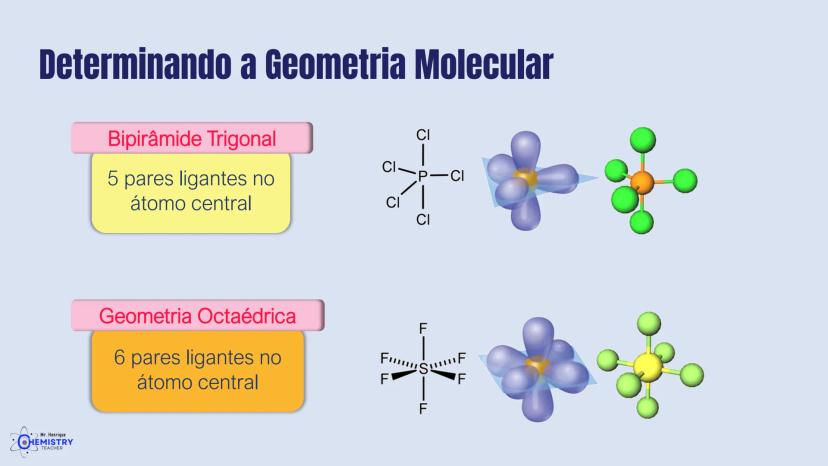
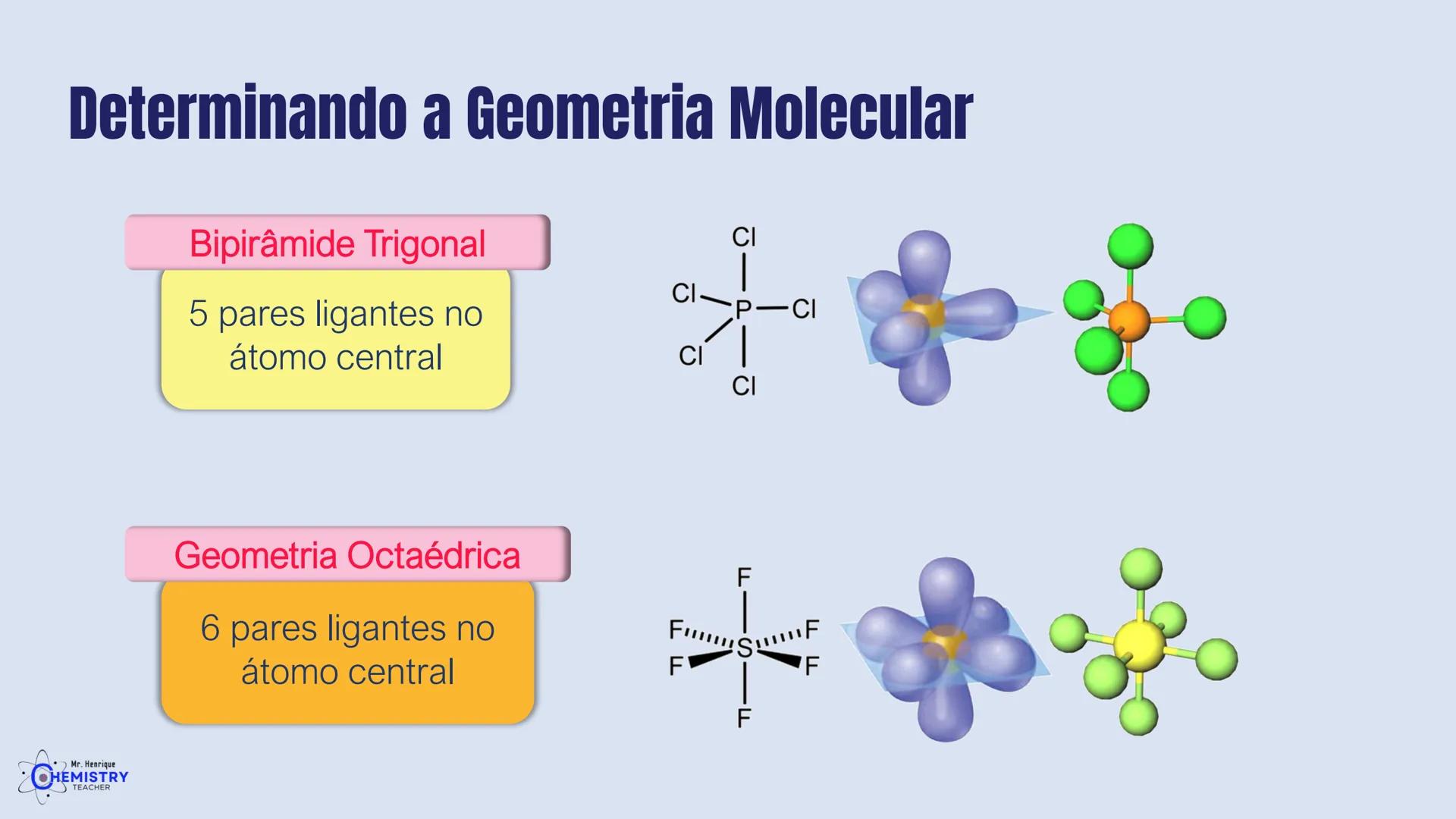
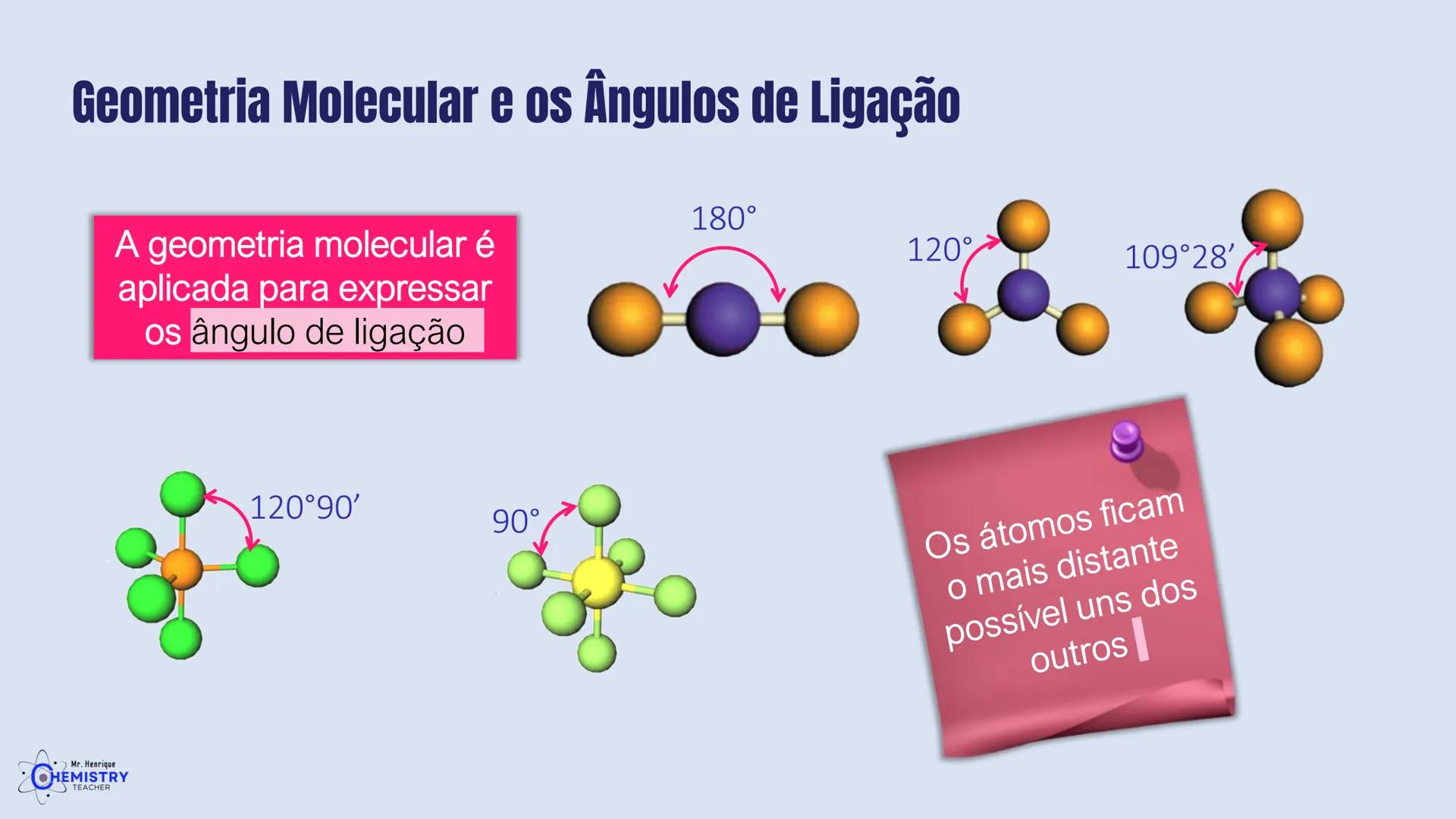
A geometria de bipirâmide trigonal acontece quando o átomo central forma cinco ligações (tem cinco pares ligantes). Nesta configuração, três átomos ficam no mesmo plano formando um triângulo equilátero (como na geometria trigonal plana), e os outros dois ficam acima e abaixo desse plano, formando os "polos" da bipirâmide.
Um exemplo desta geometria é o PCl₅ (pentacloreto de fósforo), onde o átomo de fósforo está ligado a cinco átomos de cloro.
A geometria octaédrica ocorre quando o átomo central forma seis ligações (tem seis pares ligantes). Neste caso, os ligantes se posicionam nos vértices de um octaedro, que pode ser visualizado como dois quadrados superpostos e rotacionados 45° um em relação ao outro.
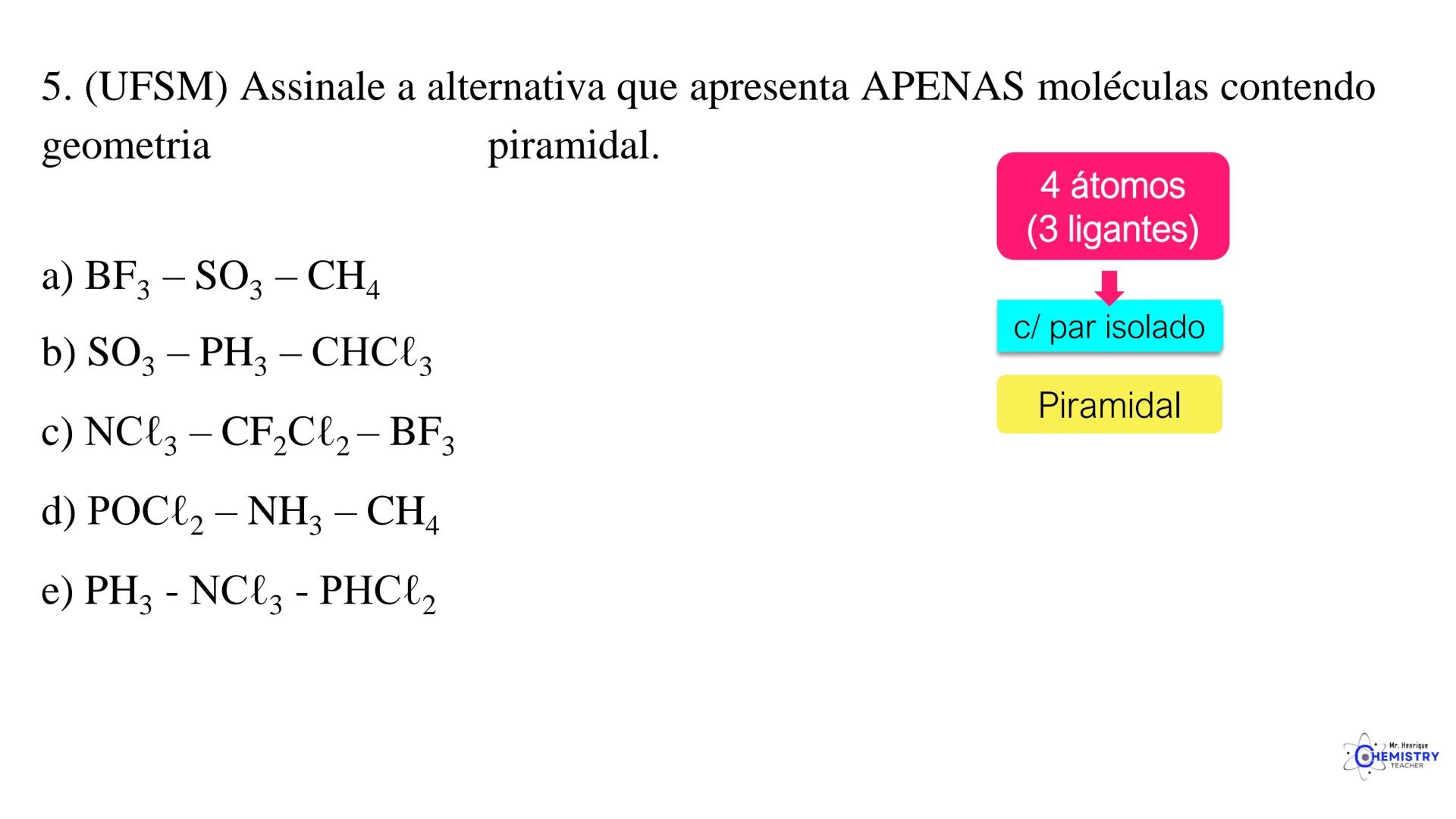
Um exemplo é o SF₆ (hexafluoreto de enxofre), onde o enxofre está ligado a seis átomos de flúor em uma disposição octaédrica.
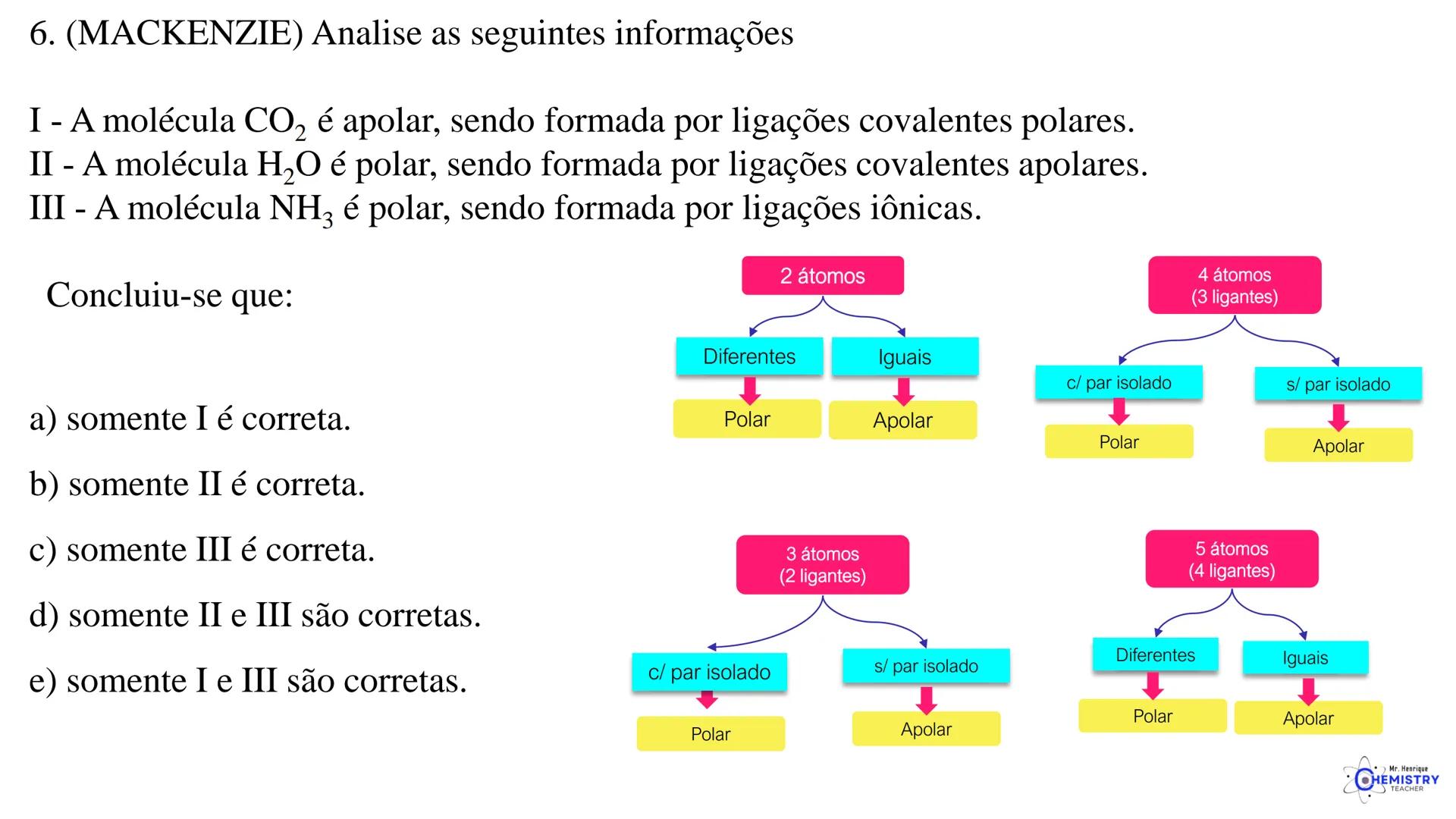
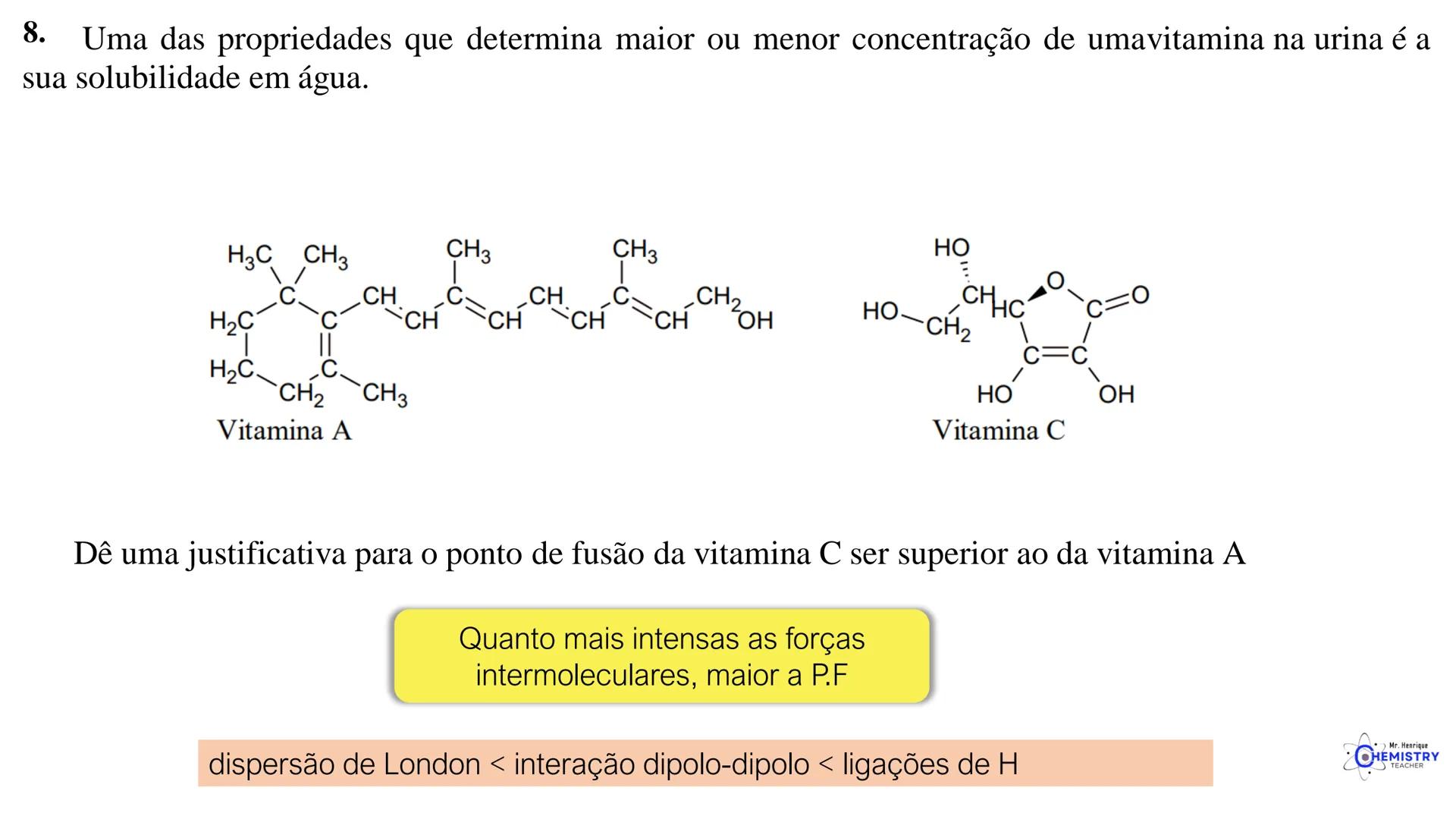
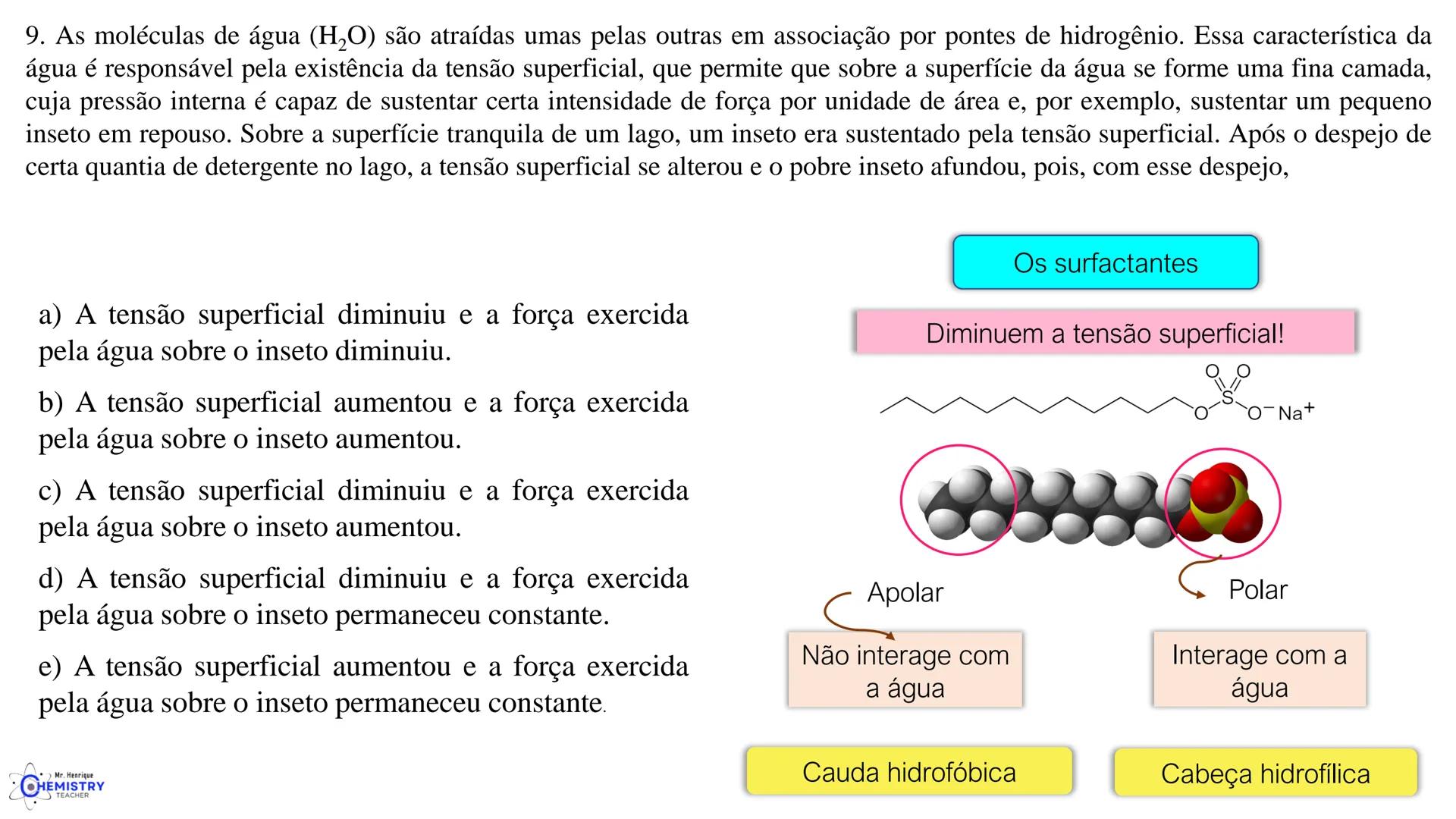
🧩 Estas geometrias moleculares mais complexas são importantes em compostos usados em medicamentos, catalisadores e materiais avançados.